
А какова же внутренняя структура молекулы фермента?
Подобно всем ферментам, лизоцим-это белок. В качестве строительного материала для всех белков природа использует двадцать различных аминокислот, соединенных друг с другом в цепь (пептидную цепь). Аминокислоты содержат разные боковые группы.
В 1963 г. была расшифрована первичная структура, т. е. число и последовательность аминокислот, лизоцима из яичного белка. Оставалось, однако, неясным, каким образом эта "белковая нить", состоящая из 129 аминокислот и 1950 атомов, образует активный центр, связывает и превращает субстраты. Только рентгеноструктурный анализ позволил выяснить пространственную структуру лизоцима. Это был третий белок (после гемоглобина, красного пигмента крови, и миоглобина, мышечного белка) и первый фермент, пространственная структура которого была установлена с помощью этого метода. Работа по расшифровке структуры лизоцима была начата в 1960 г. Давидом Филлипсом и другими членами Лондонского Королевского общества. Весной 1965 г. "без большой затраты нервов, но с довольно большими затратами труда" было получено первое пространственное изображение лизоцима, на котором была видна не строго вытянутая нитевидная, а скрученная молекула, казавшаяся на первый взгляд спутанным клубком.
На рис. 3 изображена такая молекула; при этом для наглядности приведен лишь "остов" пептидной цепи. Если этот "скелет обрастет мясом", т.е. будет дополнен боковыми группами аминокислот, то получится компактная структура яйцевидной формы, посередине которой проходит глубокая щель (рис. 4). Таким образом, молекула фермента - это относительно прочное тело. Используя изображение пространственной структуры лизоцима, очень удобно изучать, какие химические группы и какие взаимодействия участвуют в образовании этой компактной структуры. Стабильность молекулы обеспечивают различные боковые группы аминокислот. Они так "нанизаны" на пептидную цепь, что "торчат" в разные стороны, как щетинки ершика для мытья бутылок. При сворачивании же цепи в клубок эти группы могут, таким образом, легко вступать во взаимодействие. Особую жесткость структура приобретает за счет прочных химических связей, образующихся между соседними серусодержащими боковыми группами (S-Н) двух остатков цистеина. Возникающие при таком взаимодействии четыре дисульфидных мостика S-S служат важнейшими опорами пространственной структуры лизоцима. С помощью пространственной модели лизоцима легко показать, каким образом благодаря наличию полярных и неполярных боковых групп аминокислот стабилизируется глобулярная пространственная структура в водной среде.
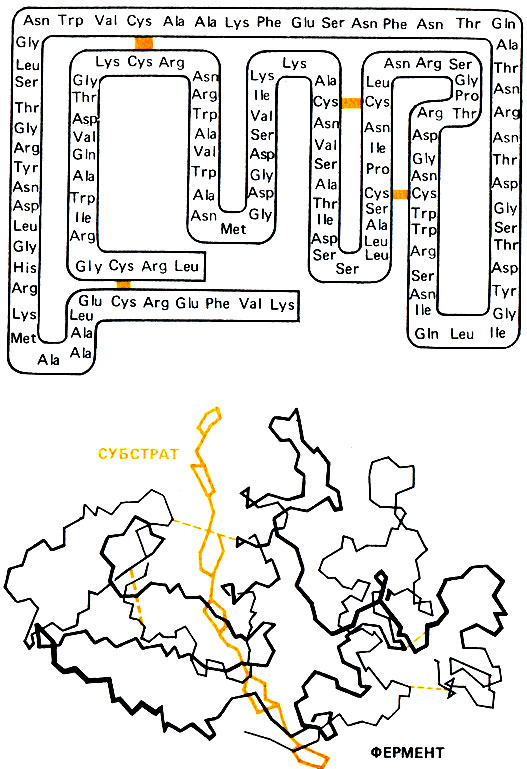
Рис. 3. Вверху - первичная структура лизоцима, последовательность аминокислот в молекуле лизоцима. Все 20 L-аминокислот, из которых состоят белки, представлены различным числом остатков: аланин (Ala), аргинин (Arg), аспарагин (Asn), аспарагиновая кислота (Asp), цистеин (Cys), глутамин (Gin), глутаминовая кислота (Glu), глицин (Gly), гистидин (His), изолейцин (Не), лейцин (Leu), лизин (Lys), метионин (Met), фенилаланин (Phe), пролин (Pro), серии (Ser), треонин (Thr), триптофан (Trp), тирозин (Туг) и валин (Val). Внизу: третичная структура лизоцима - расположение в пространстве полипептидной цепи. Для наглядности изображены только "скелеты" полипептидной цепи фермента и сахарных колец субстрата. На первичной и третичной структурах выделены дисульфидные мостики между парами остатков цистеина
Полярные боковые группы (например, СОО-, NH3+) несут электрические заряды. Поскольку молекула воды также полярна (атом кислорода несет отрицательный, а атом водорода - положительный заряд), вода сразу же вступает во взаимодействие с полярными боковыми группами аминокислот. Неполярные боковые группы (например, СН3), напротив, не несут электрического заряда и поэтому не взаимодействуют с водой.
Полярные группы гидрофильны ("любят" воду), и поэтому они обращены наружу, в воду. Неполярные боковые группы, напротив, гидрофобны ("враждебны" воде), и поэтому они стремятся обособиться от водной среды. Это в свою очередь возможно лишь тогда, когда они так обособлены внутри молекулы фермента, как капельки масла в воде. Благодаря этому молекула сохраняет свою глобулярную структуру.
Молекулы липидов (жиров) состоят из полярной "головы" и неполярного "хвоста". При взбалтывании в воде (эмульгировании) все полярные гидрофильные "головы" ориентируются наружу к поверхности воды, а неполярные гидрофобные "хвосты", напротив - вовнутрь масляной капли. Таким образом, капля приобретает сферическую форму. На аналогии масляной капли и белковой молекулы основано моделирование структуры белка (рис. 4а).
Наряду с взаимодействием боковых групп в молекуле белка (лизоцима) имеются также непрочные связи и между соседними атомами кислорода и водорода "остова" различных аминокислот (водородные мостики).
Бросающаяся в глаза глубокая щель в молекуле лизоцима может представлять собой только активный центр. Впервые благодаря рентгеноструктурному анализу удалось увидеть активный центр фермента! Однако, как присоединяется к активному центру и расщепляется в нем субстрат, откуда берется энергия для расщепления-на эти вопросы пространственное изображение не могло дать ответа. Впоследствии Филлипс говорил: "Я должен признаться, тогда я действительно знал довольно мало о механизме действия ферментов". На основе найденной пространственной структуры Филлипсу удалось постепенно сконструировать пространственную модель лизоцима из проволоки и шариков. Была построена (также из проволоки) пространственная модель субстрата, которая состояла из шести соединенных в цепь сахарных колец, каждое в конформации* кресла. Наконец, настал волнующий момент - завершение многолетней работы. Филлипс взял модель субстрата и попытался встроить ее в активный центр модели фермента. В соответствии с принципом "ключа и замка" первые три сахарных кольца совершенно точно подходили к верхней половине щели. Однако с четвертым сахарным кольцом возникли проблемы. В форме "кресла" оно плохо подходило к щели: различные его атомы "вступали в конфликт" с боковыми группами аминокислот активного центра. И тогда Филлипсу пришлось сделать решающий шаг: изогнуть проволочную модель четвертого сахарного кольца, придав ему "неестественную", напряженную, в значительной мере плоскую форму "ванны". В таком виде это кольцо подходило к активному центру совершенно точно! Очевидно, точно так, как на модели, лизоцим функционирует и в действительности. Он изгибает 4-е сахарное кольцо, изменяет его форму и таким образом "подгоняет" его к активному центру. После изменения пространственной структуры 4-го кольца 5-е и 6-е кольца очень легко подошли к щели в исходной конфигурации "кресла". И ведь именно в месте соединения изогнутого напряженного 4-го кольца и "нормального" 5-го кольца происходит расщепление субстрата! Кроме того, удивительным было, что в щель лизоцима "выходили" преимущественно неполярные аминокислоты, боковые группы которых, следовательно, не несли никакого электрического заряда, однако в непосредственной близости к подлежащей расщеплению связи между 4-ми 5-м кольцами находилась полярная боковая группа аспарагиновой кислоты Asp-52, несущая довольно существенный отрицательный заряд. Это не могло быть случайностью! Прямо напротив полярной группы аспарагиновой кислоты в щели находится боковая группа глутаминовой кислоты Glu-35. Обе боковые группы буквально "зажимали в тиски" расщепляемую связь. С помощью сконструированной модели фермента воспроизведение процесса химической реакции (расщепления субстрата) стало почти детской игрой.
* (Конформация - геометрическая форма, принимаемая молекулой органического соединения при свободном вращении отдельных фрагментов молекулы вокруг простых углерод - углеродных связей.- Прим. перев.)
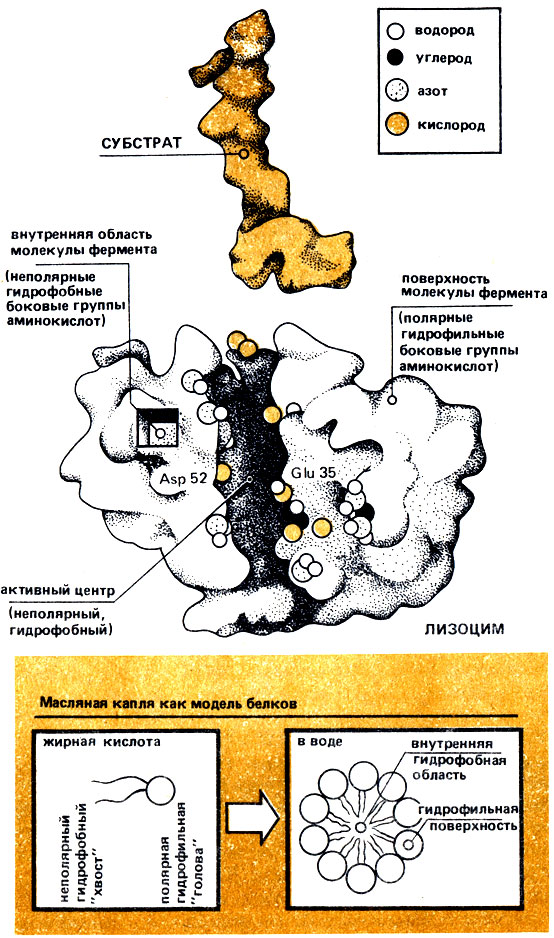
Рис. 4а. Третичная структура лизоцима и его субстрата. Изображены все атомы обеих молекул, выделены боковые группы аминокислот активного центра, участвующие в связывании и превращении субстрата. Внизу - модель капли масла; в воде гидрофобные неполярные группы концентрируются внутри молекулы фермента, гидрофильные полярные группы, напротив, обращены наружу в сторону водной среды
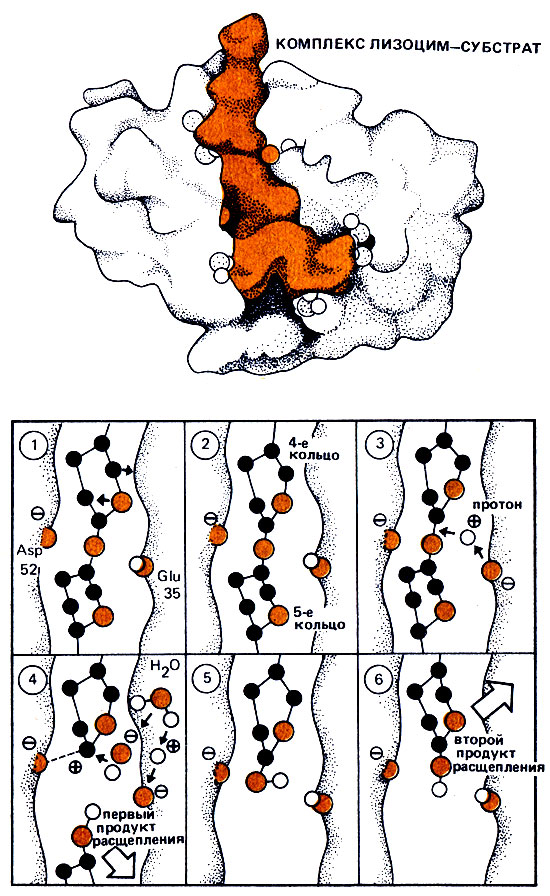
Рис. 4б. Связывание и превращение субстрата в активном центре лизоцима. Показан процесс расщепления субстрата во времени. Для удобства изображены только два сахарных кольца, между которыми происходит расщепление (4-е и 5-е кольца; показаны лишь основные атомы "скелета"). 1 - связывание субстрата в активном центре; 2 - изменение формы 4-го сахарного кольца; 3 - протон H+ глутаминовой кислоты Glu атакует связь между 4-м и 5-м сахарными кольцами; 4 - в результате образуется ион карбония C+ у 4-го сахарного кольца, который стабилизируется отрицательно заряженной группой аспарагиновой кислоты Asp. Связь между 4-м и 5-м кольцами разрывается. первый продукт расщепления (5-е и 6-е кольца) покидает активный центр. ион карбония связывается с гидрокильным ионом OH- из молекулы воды. Протон молекулы воды занимает свободное место на глутаминовой кислоте в активном центре; 5 - образовался второй продукт расщепления (1-е - 4-е кольца), который выводится из активного центра; 6 - произошла полная регенерация фермента. Может связываться и превращаться следующая молекула субстрата
На рис. 4 изображен весь механизм расщепления субстрата, образования и высвобождения двух продуктов расщепления. Поскольку расщепление субстрата протекает с участием молекулы воды, речь идет о гидролазе. Следовательно, лизоцим относится к гидролизам.
Таким образом, впервые был выяснен механизм ферментативной реакции вплоть до атомарного уровня. Кроме того, модель лизоцима очень удобна для изучения общих принципов структурной организации ферментов. Интересно, что активный центр образуется в основном неполярными группами, т.е. он существенно отличается от полярной поверхности фермента. Немногочисленные полярные группы активного центра играют важную роль в связывании и превращении субстрата. Отмеченные на рис. 4а боковые группы аминокислот активного центра образуют водородные мостики с молекулой субстрата и тем самым удерживают ее в нужном положении. Для всех ферментов, пространственные структуры которых были расшифрованы позднее, открыты те же возможности для моделирования, как это сделано для лизоцима. Все молекулы ферментов имеют форму сферы, яйца или почки со щелью или по крайней мере с небольшим углублением или впадиной на поверхности, где и находится активный центр.
Еще один новый вывод следовал из модели лизоцима. В соответствии с принципом "ключа и замка" Фишера можно было ожидать, что субстрат по форме должен совершенно точно подходить активному центру. В действительности же молекула субстрата проникает в активный центр только после некоторого изменения своей формы под действием фермента. Но и этого, оказывается, недостаточно. Происходит не только изменение формы молекулы субстрата. Как показал рентгеноструктурный анализ, при связывании субстрата имеет место также сужение и углубление щели активного центра лизоцима! Тем самым высказанная в 1958 г. Даниелем Кошландом гипотеза "индуцированного соответствия" получила блестящее подтверждение. В соответствии с этой гипотезой субстрат и фермент скорее можно сравнить не с ключом и замком; более правильно использовать такую гибкую модель, как рука и перчатка: рука (субстрат) должна войти в скомканную перчатку (фермент). Ведь перчатка не есть точная копия руки. Кроме того, на руку надевают и варежки, и перчатки, имеющие различную форму. Лишь после того, как перчатка надета на руку, она точно "подгоняется" к руке, т.е. переходит в состояние "индуцированного соответствия". Итак, после активного взаимодействия фермент и субстрат уже точно подходят друг к другу. Восторг, вызванный расшифровкой механизма действия лизоцима, привел к тому, что принцип его действия, состоящий в изменении формы субстрата, поспешно распространили на все ферменты. На самом же деле причины высокой каталитической активности ферментов значительно сложнее.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'