
Уловка ферментов
Ферменты ускоряют химические реакции в 100 миллионов-1 триллион (108-1012) раз. Предположим, что фермент ускоряет реакцию в 1010 раз, тогда количество продукта, получаемое по ферментативной реакции за 1 секунду, могло бы быть получено в отсутствие фермента лишь за 300 лет! Скорость таких реакций вряд ли вообще измерима. Большинство реакций обмена веществ в отсутствие ферментов протекало бы в организме настолько медленно, что они были бы бесполезны. Поэтому сама жизнь возможна лишь благодаря наличию ферментов.
Чтобы понять удивительные возможности ферментов, необходимо знать, как осуществляются химические реакции. Для того чтобы вещества могли вступать в реакцию друг с другом, они должны быть активированы, т.е. приведены в реакционно-способное состояние. Энергия, необходимая для этого, называется энергией активации.
Для объяснения энергетики химической реакции удобно воспользоваться аналогией с горным ландшафтом. Исходные вещества реакции можно сравнить с камнями, которые лежат в седловине на одном склоне горы; противоположный же склон спускается в более глубокую долину (рис. 5). Камни из седловины могут скатиться в долину (т.е. превратиться в продукты химической реакции) только в том случае, если им будет сообщена соответствующая энергия активации, которая поднимет их на вершину горы и столкнет вниз. При химических реакциях вещества получают энергию активации за счет повышения температуры или давления. Конечно, подобные пути невозможны в живой клетке, поскольку это убило бы ее.
В общем случае все катализаторы снижают энергию активации. Образно говоря, они так сильно срезают вершину горы, что требуется очень незначительная энергия для ее преодоления. Такие незначительные количества энергии можно легко сообщить исходным веществам в виде частных небольших порций. Катализаторы можно сравнить с проводником в горах, который выбирает путь не через вершину горы, а через несколько существенно более низких горных перевалов с тем, чтобы по возможности сэкономить силы.
Равновесные состояния символизируют седловина (исходное состояние) и долина (конечное состояние), а вершина соответствует лабильному переходному состоянию активированного комплекса. Ферменты не влияют на положение равновесия реакции (это означало бы изменение уровней расположения седловины и долины), а способствуют лишь более быстрому достижению этого равновесия. Следовательно, они ускоряют процесс, который протекал бы и без их участия, но значительно медленнее (во многих случаях настолько медленно, что скорость реакции нельзя было бы измерить). Таким образом, ферменты резко понижают энергию активации и тем самым существенно облегчают протекание реакции. Впрочем, как это происходит, вопрос для энзимологов спорный*. Очевидно, и не существует одной общей схемы для всех ферментов.
* (См. "Предисловие редактора перевода".)
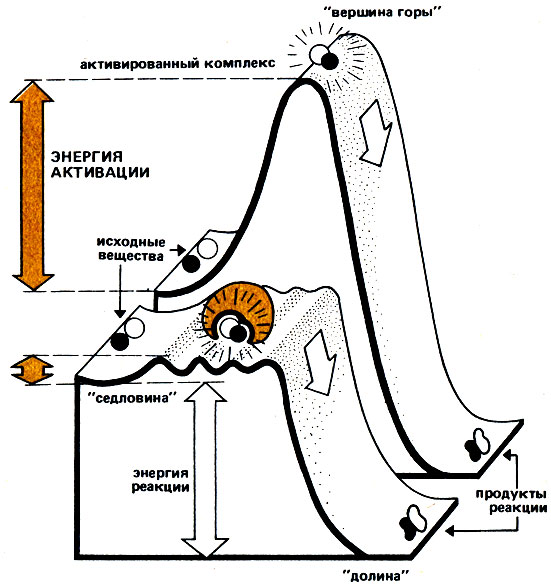
Рис. 5 Энергетические условия химической реакции без катализа (задний план) и при ферментативном катализе (передний план). Энергия активации обеих реакций (высота 'вершины горы') существенно различается
С одним из возможных путей мы познакомились на примере лизоцима. Фермент влияет на конфигурацию субстрата, переводит его в напряженное состояние, из которого он может выйти только путем образования продукта реакции. Большая часть необходимой для реакции энергии, вероятно, сообщается уже при связывании субстрата в активном центре. Если в растворе взаимодействие веществ осуществляется случайным образом, то с помощью фермента партнеры целенаправленно подводятся друг к другу в активном центре. Поэтому вероятность протекания реакции сильно увеличивается. В активном центре на очень небольшом участке сосредоточены высокореакционноспособные химические группы фермента, причем они ориентированы в пространстве таким образом, что находятся в непосредственном контакте с подлежащими превращению группами субстратов. Последние попадают при этом как бы под целенаправленный, хорошо скорректированный интенсивный "обстрел". Поскольку активный центр образован в основном неполярными группами, эту область фермента можно сравнить с органическим (неполярным) растворителем. Органические реакции протекают в органических неполярных растворителях в основном существенно быстрее, чем в полярной воде. Поэтому в "органическом окружении" активного центра небольшое число заряженных полярных боковых групп аминокислот становится "сверхреактивными" по сравнению с их поведением в водном растворе.
Таким образом, теперь должно быть ясно, с чем связано преимущество ферментативных реакций по сравнению с "нормальными" некатализируемыми химическими реакциями, а также реакциями с традиционными катализаторами. Как само собой разумеющееся следует и то, что ферменты просто должны быть огромными цепочечными молекулами, так как только в этом случае они, сворачиваясь в глобулу, могут сосредоточить в одной области необходимые для реакции группы, чтобы те в нужное время и в нужном месте могли вызвать реакцию. При этом молекула фермента-это не какое-то застывшее образование, а гибкая, эластично меняющая форму структура. Вот в чем секрет эффективности ферментов!
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'