
2. Гидролазы
Гидролазами называют ферменты, катализирующие расщепление субстрата на его компоненты с присоединением к ним воды, и у грибов это часто бывают экзоферменты, выделяющиеся в окружающую среду. В их число входят карбогидразы, расщепляющие белки и пептиды, различные олиго- и полисахариды, протеолитические ферменты, расщепляющие белки и пептиды, к которым примыкают кератинолитические, разрушающие кератин рога, шерсти и перьев, фибринолитические, гидролизующие фибрин крови, а также расщепляющие фосфорные и другие сложноэфирные связи эстеразы, среди которых различают гидролизующие жиры липазы, фосфолипазы и рассмотренные выше фосфатазы.
Липазы и фосфолипазы*. Липазы относятся к числу гидролитических ферментов из категории эстераз, расщепляющих жиры, которыми весьма богаты многие грибы, использующие жиры как источник углерода. Липазы обильно встречаются у многих почвенных, плесневых и паразитных грибов.
* (Даны рабочие названия ферментов по старой номенклатуре (Диксон, Уэбб, 1982).)
Реакция, производимая грибными липазами, большей частью состоит в отщеплении от глицеридов жирных кислот, находящихся в положении С-1 или С-3 атомов глицерина (табл. 6.7) в последовательном порядке от С-3 к С-1 ацильным группам.
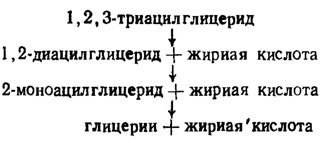
Таблица 6.7. Катализируемая грибной липазой деградация триацилглицерида (Weete, 1980)
Для отщепления последней ацильной группы в положении С-2 необходима изомеризация, переводящая ее в положение С-1 или С-3. Это осуществляется грибами, поскольку они почти всегда способны к полному деацилированию триглицеридов. Однако у некоторых форм, например у Aspergillus flavus, такой позиционной специфичности нет, а у Geotrichum candidum специфичность проявляется в приуроченности к ненасыщенным жирным кислотам со структурой Δ9 независимо от их положения в отношении атомов углерода глицерина. Это наиболее специфичная из всех липаз грибов.
У Saccharomyces cerevisiae липаза связана с клеточной мембраной и изолируется из нее при переваривании клеточной оболочки. Большей частью липазы грибов относительно стабильны и имеют оптимум действия при рН 8,0. Скорость гидролиза липазой триглицеридов по положению С-1 у Mucor javanicus выше, чем диглицеридов по положениям С-1, С-3, вероятно, потому, что диглицериды менее электрофильны, и она падает в направлении: триглицериды → С-2, С-3-диглицериды → моноглицериды. Быстрее гидролизуются также триглицериды, содержащие олеиновую и линолевую жирные кислоты, чем линоленовую, вероятно, в результате изменения под ее влиянием конфигурации триглицерида вследствие обилия двойных связей и затруднения образования его комплекса с энзимом.
Образование липаз грибами - важный элемент процесса сыроварения с применением грибных заквасок на основе Penicillium roquefortii и P. kamemberti. Острый вкус мягких сыров типа рокфора зависит в значительной мере от свободных жирных кислот, вторично образующихся сложных эфиров и альдегидов, являющихся конечными продуктами процессов, катализируемых липазами.
Виды грибов, обильно образующие липазы, обычно являются виновниками прогоркания масел или порчи масличных семян (Eggins, Coursey, 1968), туалетного мыла, коррозии и закупорки масляных и топливных баков, маслопроводов авиационных моторов, что приводило даже к воздушным катастрофам. Порча грибами произведений живописи с использованием масляных красок тоже зависит от разрушающих способностей этих грибов, обильно выделяющих липолитические ферменты (Курицына, 1968).
Фосфолипазы, гидролизующие фосфолипиды, изучались у немногих грибов. Всего насчитывают порядка пяти таких энзимов, обозначаемых как А1, А2, В, С и Д (рис. 6.9) и отличающихся по местам производимого ими гидролиза (Weete, 1980). Фосфолипазы A1 и А2 катализируют отщепление ацилированных жирных кислот по положению С-1 (A1) и С-2 (А2). Эти реакции способна производить также фосфолипаза В. Фосфолипазы С и Д являются собственно фосфатазами, так как они отщепляют фосфорную кислоту по ее -Р-О- связям, первая в месте контакта с С-3 атомом глицерина, а вторая с основанием, например с холином или этанола-мином. Соответственно продуктами этих реакций оказываются в первом случае фосфорилированное основание (например, фосфатидилхолин), во втором одно основание (например, холин).
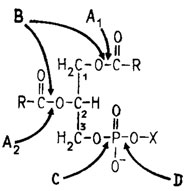
Рис. 6.9. Места действия на фосфолипиды фосфолипаз А1, А2, В, С и Д (Weete, 1980)
Обнаруженные у грибов фосфолипазы способны производить полное деацилирование 1,2-диацилглицерофосфатидов до глицеро-3-фосфата и двух жирных кислот, а также до 1,2-диацилглицерида и фосфорилированного основания (например, о-фосфатидилхолина) и являются широкоспецифичными. Фосфолипаза D была открыта только у растений.
Наиболее полно была исследована фосфолипаза из Penicillium notatum, активная в отношении диацилфосфолипидов и стимулируемая кардиолипином и фосфатидилинозитом. Фосфолипаза А была найдена в сухих дрожжах и гидролизовала фисфатидилхолин, трансформируя его в лизофосфатидилхолин и глицеро-3-фосфатидилхолин. Фосфолипаза В из P. notatum активировалась анионами, возможно, вследствие участия их в диспергировании фосфолипидов в результате увеличения отрицательного потенциала субстрата. Это подтверждается возможностью их замены обработкой ультразвуком. Оптимальная активность фосфолипазы В из P. notatum достигается при рН 4,0 и усиливается при введении -S-S- связей. Фосфолипаза В была также найдена у Sclerotium rolfsii и имела при этом оптимум действия при рН 4,5.
О нахождении фосфолипазы С было сообщено некоторыми авторами для дрожжей, бактерий Ervinia carotovora и некоторых фитопатогенных грибов. Необычный энзим с фосфолипазной активностью был найден у Rhisopus arrhizus, катализирующий гидролиз триацилглицеридов в положении С-1 и С-3. Сходный с энзимом Rhisopus фермент был обнаружен в панкреатической железе свиньи.
Карбогидразами называют ферменты, производящие сопровождаемое гидролизом расщепление углеродсодержащих безазотистых соединений, например, различной степени сложности углеводов. Поскольку именно такие субстраты чаще всего используются грибами как источник углерода, ферменты этого типа, образуемые ими, весьма обильны и разнообразны.
К ним относятся прежде всего ферменты, действующие на дисахариды, такие как инвертаза (или сахараза), расщепляющая сахарозу на фруктозу и глюкозу, трегалаза и мальтаза, делящие соответственно на две молекулы глюкозы трегалозу и мальтозу, и лактаза, расщепляющая на глюкозу и галактозу дисахарид лактозу. Ферменты этой категории, будучи широко распространены у грибов, имеются все же не у всех. Например, у Chaetoceratostoma longirostre отсутствует инвертаза, и при росте без глюкозы, которая способствует образованию у нее красного пигмента, ее колония на среде с сахарозой остается неокрашенной. Вследствие этого данный вид может служить тестом для обнаружения инвертазы у других грибов, в совместной культуре с которыми на среде с сахарозой его колония становится окрашенной пигментом, синтезируемым на базе глюкозы, образующейся в результате действия инвертазы культивируемого вместе с ним вида гриба.
Ферменты этого типа могут быть не только конститутивными, но и адаптивными. Например, у Saccharomyces fragilis таковым является инвертаза, образование которой усиливается очень резко на среде с сахарозой и которая почти не образуется на средах с рафинозой, лактозой или мелибиозой (Девис и др., 1966). У других дрожжей адаптивным ферментом является энзим, участвующий в усвоении галактозы, образование которого стимулируется выделенным из них термостабильным фактором.
Трегалаза, видимо, также является адаптивным ферментом у миксомицета Dictyostelium discoideum, постепенно накапливающимися у него в процессе прорастания спор (Cotter, Raper, 1966). Кроме миксомицета Dictyostelium трегалаза была также обнаружена в мицелии и склероциях в культуре Sclerotinia sclerotiorum Wang-Sy-Jing, Le Tourneau, 1972). Очищенный фермент имел оптимальную активность в пределах рН около 5,0 и константу Михаэлиса, равную 1,7⋅10-3. Еще ранее трегалаза была также обнаружена у базидиомицета Schizophyllum commune (Williams, Niederpruem, 1968).
Некоторые дрожжи накапливают расщепляющие дисахариды ферменты в больших количествах, что позволяет использовать их в промышленных целях. Например, к числу таких видов относится Fabrospora fragilis, образующая β-галактозидазу (лактазу) и оказавшаяся наиболее эффективной среди пятидесяти испытанных одновременно с ней штаммов дрожжей.
Олигосахариды с α-D-галактозным остатком, широко распространенные у растений и животных, гидролизуются α-галактозидазой, встречающейся как среди дрожжей, так и нитчатых грибов. Среди 89 культур дрожжей, принадлежащих к 21 роду, она обнаружена только у двух испытанных видов рода Schwanniomyces, S. occidentalis и S. alluvius, причем наиболее активен был первый из этих видов, культивируемый на среде с молочной сывороткой (Улезло и др., 1980). Среди нитчатых дейтеромицетов хорошим продуцентом α-галактозидазы оказался штамм из рода Cephalosporium (Cephalosporium sp. 237), из культуральной жидкости которого энзим осаждался этанолом или ацетоном и гидролизовал все три использованных субстрата: n-нитрофенил-α-D-галактопиранозид (n-НФГ), к которому его сродство было наибольшим, мелибиозу и рафинозу, но с оптимальной активностью при разных рН. Для гидролиза n-НФГ оптимальная активность находилась при рН 5,5, для мелибиозы - при рН 5,0 и для рафинозы - при рН 6,0. Препарат фермента содержал примеси протеазы и инвертазы, был стабилен в диапазоне рН от 5,0 до 9,0 и терял 40% активности в течение 10 мин при 50°С. Для гидролиза субстрата n-НФГ оптимальная активность энзима наблюдалась при 40°С (Запрометова и др., 1982).
Среди ферментов, расщепляющих сложные полисахариды, наиболее распространенным у грибов энзимом является амилаза. Она представляет собой, по существу, не один фермент, а комплекс энзимов, гидролизующих крахмал. В составе этого комплекса в настоящее время числятся (Яровенко, Устинников, 1975): 1) α-амилаза (по промышленной терминологии АС), гидролизующая крахмал по связям 1-4 до неокрашивающихся йодом декстринов, а также до мальтозы и глюкозы; 2) декстриназа (ДС), гидролизующая конечные декстрины до редуцирующих сахаров, иначе называемая олиго-1-6-глюкозидазой по ее способности расщеплять крахмал по 1-6-глюкозидным связям; 3) обнаруженная Фениксовой и Шиловой (1964, 1970) в культуре Aspergillus awamori, а позднее и у многих других плесеней глюкоамилаза, гидролизующая крахмал до глюкозы как по связям α-1,4, так и по α-1,6 (ГА). К числу ферментов комплекса амилазы присоединяют обычно и мальтазу (МС).
Декстриназа помимо способности расщеплять крахмал по 1-6-глюкозидным связям оказалась способной формировать из глюкозидных остатков изомальтозу, панозу, мальтотриозу и другие сходные сахара, т. е. обладала одновременно свойствами трансгликозилазы с общей схемой действия фермента:
Две молекулы мальтозы ↔ мальтотриоза + глюкоза.
Фермент этого типа особенно характерен для серии вида Aspergillus niger (А. niger, A. batatae, А. awamori), но имеется также и у А. oryzae, хотя последний характерен больше высокой активностью α-амилазы.
α-Амилаза грибов ингибируется тяжелыми металлами, а кальций является ее важным компонентом, стабилизирующим конформацию фермента. Она достаточно кислотоустойчива, так как сохраняет активность при рН 2,5 в течение 30 мин и имеет оптимальную активность при рН порядка 4,5-4,8. Большинство глюкоамилаз также действуют в кислой зоне рН (3,5-5,5), но у некоторых грибов, например у Saccharomyces italicus, встречаются нейтральные глюкоамилазы с активностью при рН от 6,0 до 7,5. Этот фермент способен гидролизовать даже 1-3-глюкозидные связи, и не только крахмал, но и конечные декстрины и гликоген. Он был обнаружен также у мукорового гриба Rhizopus delamar и у Endomycopsis sp. Температурные пределы его действия колеблются от 40 до 60°С.
Амилаза почти всегда является конститутивным ферментом, даже у дереворазрушающих грибов (Lyr, 1959b), и широко распространена в очень разнообразных таксономических группах. Не содержат ее только некоторые оомицеты, например виды рода Phytophthora, выделяющие вместо нее вещества, индуцирующие биосинтез амилазы в пораженных ею клубнях картофеля. У почвенных плесневых грибов из родов Aspergillus и Penicillium амилаза распространена особенно широко, и именно виды этих родов обычно служат ее источниками для промышленности. Комплексы ферментов, составляющих их систему, гидролизующую крахмал, даже у видов одного рода могут быть неодинаковыми, от чего зависит выбор разных продуцентов для различных практических целей. Например, у Aspergillus oryzae преобладает α-амилаза с оптимумом активности при рН 5,0-5,4, тогда как группа А. niger обычно богаче глюкоамилазой, декстриназой и мальтазой. Индуктором образования у А. niger амилазы является продукт гидролиза крахмала мальтоза, а глюкоза подавляет ее синтез.
Среди видов рода Ascochyta и у близкого к ней рода Phoma присутствуют одновременно и α-амилаза, и глюкоамилаза, и отдельные виды отличаются не столько по относительному их количеству, сколько по общему объему их продукции и скорости их формирования. Наиболее продуктивной оказалась в заданных условиях среды Ascochyta cucumeris, а наименее - А. pisi и представитель рода Phoma, P. medicaginis (Решетникова, Успенская, 1981).
Амилаза Penicilium chrysogenum подавлялась солями аммония, а активировалась фенилуксусной кислотой и кукурузным экстрактам и оказалась наиболее активной в нейтральной зоне рН от 6,4 до 7,0.
Близкому к амилазе ферменту, производящему гидролитическое расщепление инулина, было присвоено название инулазы, но в данное время ферменты этого типа называют фруктангидролазами. Согласно ранним исследованиям инулаза является адаптивным ферментом, образуемым Aspergillus niger в основном при росте его на среде с инулином, но не на средах с глюкозой или мальтозой. Название фруктангидролаз присвоено ферментам, приспособленным к субстратам, в состав которых (как, например, в состав инулина) входит фруктоза. Фруктангидролаз различают три категории: 1) собственно инулазу, гидролизующую только инулин; 2) менее специфичную гидролазу, расщепляющую кроме инулина леван и сахарозу; 3) леваназу, фруктангидролазу, расщепляющую только леван и освобождающую из него помимо фруктозы ее олигосахариды (Элисашвили и др., 1980). Последняя оказалась полезной в стоматологии для профилактики и лечения кариеса.
Внеклеточную леваназу оказалось возможным получать из культуральной жидкости Fusarium solani 68 при помощи осаждения ее сульфатом аммония и гель-хроматографии на сефадексе G-150. Максимальная активность ее наблюдалась при рН 6,8, температуре 45°С и концентрации полисахарида 6,7 мг/мл. Фермент отличался стабильностью при рН от 5,0 до 7,5 и при 40-45°С. Константа Михаэлиса для этого энзима была равна 1,5-10-6 М.
Комплекс ферментов, разрушающих клетчатку до целлобиозы и затем до глюкозы, носит общее название целлюлазы. Эффект ее действия в отношении древесины особенно ярко виден у грибов, возбудителей ее деструктивной гнили, при которой древесина теряет свою волокнистую структуру, буреет, растрескивается и легко растирается в порошок, что особенно характерно для поражения домовыми грибами - Serpula (Merulius) lacrymans, Coniophora puteana (C. cerebella) и другими. Этапы разрушения древесины этими и другими грибами были тонко изучены на цитохимическом и электронно-микроскопическом уровне (Liese, Schmied, 1962; Liese, 1970; Peek et al., 1972).
Уже более двадцати лет назад было установлено, что целлюлоза, как и амилаза, у большинства из ее продуцентов представлена комплексом из нескольких ферментов, свойства которых была первоначально изучены (Jermyn, 1956) на модели дейтеромицета Stachybotrys atra, а позднее на других объектах (Selby, 1968). В итоге было установлено наличие у грибов комплекса из трех энзимов (рис. 6.10): 1) фактора набухания, вызывающего подготовку к дальнейшему расщеплению, и набухание высококристаллической целлюлозы, по-видимому, идентичного фактору С1 по классификации Селби; 2) термостабильной "вискозиметрической" целлюлозы, эндоэнзима, разрушающего несколько более низкомолекулярную целлюлозу, понижая ее вязкость вследствие ее расщепления на цепи меньшей длины. Конечными продуктами ее действия являются сначала олигосахариды, а потом целлобиоза и глюкоза. Расщеплять целлобиозу она не может. Видимо, она идентична с Сх-фактором по классификации Селби; 3) термолабильной β-глюкозидазы, экзоэнзима, расщепляющей β-глюкозидную связь концевого мономера глюкозы в цепи, которая является единственным продуктом действия этого фермента. Как и мальтаза в комплексе амилазы, в случае комплекса целлюлазы в него входит энзим целлобиаза, расщепляющий на две молекулы глюкозы составляющий клетчатку дисахарид целлобиозу (см. рис. 6.10).

Рис. 6.10. Схема последовательности действия целлюлитических ферментов и относительной их активности поодиночке и в смеси (Selby, 1968)
Механизм действия α- и β-глюкозидаз, соответственно расщепляющих полимеры целлюлозы по α- и β-связям, изучался тем же Джермином (Jermyn, 1958) и, по его мнению, он состоит в образовании тройного комплекса - энзим - донор - акцептор, где акцептором обычно является вода. При разрушении этого комплекса получается конечный продукт гидролиза - глюкоза. Молекулярная масса приведенных на рис. 6.10 энзимов согласуется с глубиной их действия. Она равна 55000 для "вискозиметрической" целлюлазы, 30000 для фермента C1 (фактора набухания) и всего около 5300 для β-глюкозидазы. В комплексе действие этих ферментов резко усиливается, как это видно из сравнения гидролитического эффекта компонентов комплекса поодиночке и совместно (см. рис. 6.10).
Продолжение изучения целлюлозолитических ферментов грибов в последнее время, проводившееся с привлечением продуцентов из дейтеромицетов, в частности вида Geotrichum candidum (Тиунова и др., 1982), показало наличие среди β-глюканаз специализированных типов энзимов по отношению к определенным глюкозидным связям (1-3, 1-4 или 1-6). Использование в качестве субстрата ламинарина позволило выявить у G. candidum активность 1-3-β-глюканазы, пустулина - 1-6-β-глюканазы. Выявлялись также при росте в течение 75-100 ч 1-4-β-глюканаза (Сх-фермент), образующаяся после 70 ч роста β-глюкозидаза, расщепляющая целлобиозу, и по расщеплению хлопкового волокна С1-фермент Селби. Исследование β-глюканаз с помощью изоэлектрического фокусирования в градиенте рН показало, что все эти энзимы являются кислыми белками с изоэлектрическими точками в пределах от 1,3-2,0 до 6,4 и каждый тип, судя по числу пиков кривой элюции, содержит от четырех (у 1-3-β-глюканазы) до семи (у 1-4-β-глюканазы) фракций изозимов.
Изучались также экзоцеллюлазы дереворазрушающего базидиомицета Irpex lacteus (Kanda et al., 1978). Проводилось также специальное исследование у 31 вида грибов-дереворазрушителей активности С1-фермента, которое показало, что он обнаруживается только у 7 из них, в основном являющихся возбудителями бурой гнили. К их числу принадлежали Coniophora areda, С. olivacea, С. puteana, Hygrophoropsis aurantiaca, Paxillus panuoides, Serpula himantoides и S. pinastri (Nilsson, 1974).
Наиболее энергичными разрушителями целлюлозы естественно являются дереворазрушающие грибы-базидиомицеты, которые и оказались наилучшим образом изученными в отношении их целлюлаз (см., например, Lyr, 1959b, 1960; Musilek, 1981; Nilsson, 1974). Комплексы обнаруживаемых у этих грибов целлюлитических ферментов были различны в зависимости от вида гриба. Так, у Polyporus annosus и Flammulina (Collybia) velutipes (Norkrans, 1957; Lyr, Ziegler, 1959) была найдена как термостабильная целлюлаза, так и термолабильная β-глюкозидаза с различной активностью у разных штаммов Flammulina, тогда как у Hydnum henningsii и Polyporus schweinitzii оказалась только β-глюкозидаза, дающая в качестве продукта гидролиза одну глюкозу. Напротив, у Polyporus betulinus по понижению вязкости карбоксиметилцеллюлозы была обнаружена только "вискозиметрическая" целлюлаза (Bell, Burnett, 1966). Помимо указанных здесь видов дереворазрушающих грибов целлюлаза была обнаружена у рода Irpex, у которого она стимулируется марганцем, у Phellinus igniarius (Стайченко, Федоров, 1969), у Polyporus abietinus, Tricholoma, Poria vaillantii и у видов Corticium.
Среди почвенных дейтеромицетов также встречается большое количество продуцентов целлюлаз, в чем можно убедиться, выращивая их при посеве почвенной суспензии или комочков почвы на фильтровальную бумагу (Verona, Lipidi, 1966) или на среду с добавкой в качестве источника углерода целлюлозного порошка. К числу целлюлозоразрушающих форм почвенного происхождения принадлежат различные виды Aspergillus, Cephalosporium, Chaetomium, Humicola, Malbranchia, Sporotrichum, Thermoascus и Другие. Много целлюлозоразрушителей оказывается среди термофильных видов. К числу разрушителей целлюлозы относятся также разрушители бумаги Eidamella deflexa, Sporotrichum bombycinum, Aspergillus terreus и Penicillium purpurogenum (Нюкша, 1969), а также гриб Archangium violaceum. Однако из числа дейтеромицетов наиболее активными и наилучше изученными продуцентами целлюлазы оказались Trichoderma viride, Myrothecium verrucaria (Whitaker, 1954, 1956) и Stachybotrys atra (Jermyn, 1956). У последнего из этих грибов был обнаружен набор из четырех компонентов целлюлазы, тогда как у Myrothecium verrucaria и Aspergillus niger установлены термостабильная целлюлаза и термолабильная β-глюкозидаза. У Myrothecium β-глюкозидаза оказывается более эффективной, если длина цепочек разрушаемых ею олигосахаридов возрастает с двух до пяти мономеров глюкозы в их составе.
Целлюлазы, видимо, в большинстве случаев являются адаптивными энзимами, которые не образуются на средах с глюкозой и целлобиозой, а главным образом при росте на средах с клетчаткой (Lyr, 1959). Это было установлено для Tricholoma, Polyporus annosus (Norkrans, 1957), Fomes pinicola, Schizophyllum commune, Trametes versicolor (Reese, Levinson, 1952) и целого ряда других грибов-дереворазрушителей. Оптимальное значение рН для активности этих ферментов находится обычно в пределах от 5,0 до 6,0.
К наиболее распространенным у древесных растений полимерам, которые ранее обобщали в категорию гемицеллюлоз, относятся ксиланы, преобладающие у лиственных пород, и маннаны, встречающиеся в большом количестве у хвойных. Расщепляющие их ферменты ксилаиазы и маннаназы встречаются обильно как у дереворазрушающих грибов-трутовиков, так у многих сумчатых грибов, например Chaetomium globosum (Sorensen, 1957), и дейтеромицетов. Обильны они и у паразитических грибов. Среди последних гемицеллюлазы изучались у Fusarium roseum, Sclerotium rolfsii, y Botrytis cinerea и Aureobasidium puU lulans (Berndt, Liese, 1971). При этом у Botrytis cinerea и Aureobasidium pullulans была обнаружена манианаза, у Chaetomium globosum ксиланаза, а у Sclerotium rolfsii оба этих энзима с дополнением галактаназы и α-1,6-галактозидазы. S. rolfsii оказался способным расщеплять галактомаинаны, а ряд других грибов - разнообразные пентозаны. По-видимому, большинство энзимов этого типа являются у грибов адаптивными, например, у большей части грибов образование ксиланазы стимулировалось ксиланом (Sorensen, 1957; Lyr, 1959). Оптимальное значение рН для активности этого фермента лежит, по некоторым данным, в пределах 3,0-3,8, а продуктом гидролиза является ксилобиоза, расщепляющаяся далее до ксилозы (Рипачек, 1967).
Поскольку маннаны более широко представлены у хвойных, анализировали наличие соответствующих ферментов у паразитов этих пород деревьев. Ферменты, расщепляющие α-D-маннозидные связи, были найдены у паразита ели трутовика Phellinus abietis (Zouchova et al., 1977a, б). У Р. abietis были обнаружены два типа подобных экстрацеллюлярных энзимов - типа экзоманнаназы, отщепляющей конечную группу маннозы, и эндоманнаназы, расщепляющей маннан на его олигомеры, а также α-маннозидазу.
Пектолитические энзимы широко распространены как у дереворазрушающих, так и у почвенных и особенно у фитопатогенных грибов, у которых изучалась пектолитическая способность более чем для восемнадцати видов в связи с предполагаемой ролью этих энзимов в патогенезе или в проникновении в растения через их корни.
Среди пектолитических энзимов, которые, как и другие гидролазы, часто являются комплексом ферментов, различают четыре вида: 1) протопектиназа, или пектинлиаза, освобождающая пектин из его лабильного соединения с клетчаткой; именно этот энзим считается основным виновником мацерации тканей растений, я испытывают его обычно по этому симптому при посеве гриба - продуцента на ломтики картофеля; 2) полигалактуроназа, или лектиназа (ПГ), определяемая чаще всего по понижению вязкости раствора пектина или пектата кальция, производящая разрыв полимерной молекулы полигалактуроновой кислоты, составляющей лектин, по α-1,4-уронидным связям на более низкомолекулярные фрагменты или мономеры галактуроновой кислоты (рис. 6.11); 3) пектинметилэстераза, или пектаза (ПМЭ), определяемая по титрованию освобождающихся кислых групп полигалактуроновой кислоты или спектрофотометрически; она представляет собой эстеразу, расщепляющую эфирную связь полигалактуроновой кислоты с метиловым спиртом (см. рис. 6.11). У видов, способных расщеплять высоко метоксилированные пектины, она встречается обычно в паре с полигалактуроназой (ПГ), так как последняя неспособна расщеплять такие пектины без их предварительного деметоксилирования; 4) обнаруженная позднее всех других пектолитических энзимов пектинтрансэлиминаза (ПТЭ), расщепляющая уронидные связи пектина без его предварительного деметоксилирования.
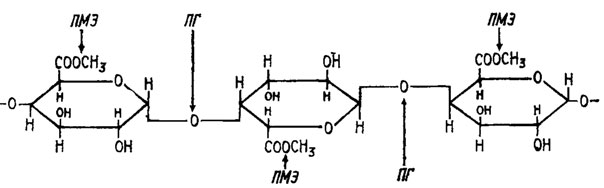
Рис. 6.11. Действие на пектин полигалактуроназы (ПГ) и пектинметилэстераэы (ПМЭ) (Банфилд, 1963)
Этот энзим сильно отличается от двух предыдущих, имеющих оптимум действия в кислой среде (при рН 4,0-5,0), тем, что его максимальная активность проявляется в щелочном диапазоне между рН 7,5 и 8,5 (Ayers, Papavizas, Diem, 1966; Васильева, Метлицкий, 1968; Васильева и др., 1968). Если исходить из этого обстоятельства, то отличающиеся по оптимальным значениям рН пектиновые энзимы Botrytis cinerea (оптимум рН 4,0-5,0) и Pythium debarianum (оптимум рН 8,0-9,0) должны быть: первый - полигалактуроназой, а второй - пектинтрансэлиминазой соответственно (Ashour, 1954). Пектолитический энзим Aureobasidium pullulans также оказывается по этому признаку пектинтрансэлиминазой (Berndt, Liese, 1971).
Полигалактуроназа, встречающаяся у Neurospora crassa, по ее описанию несколько отличается от обычной по оптимальному для ее действия рН и термолабильностью. Она разрушается при 70°С и дает в качестве продуктов гидролиза довольно высокомолекулярные полиурониды с молекулярной массой около 1300. Однако последний признак не особенно характерен, поскольку и обычная ПГ дает первоначально высокомолекулярные продукты гидролиза, постепенно распадающиеся при длительных экспозициях на мономеры. В последнее время пектинметилэстеразу и полигалактуроназу рассматривают как единый ферментный комплекс, называемый полиметилгалактуроназой, различая лишь его экзоформу, отщепляющую концевую молекулу галактуроновой кислоты, и эндоформу этого энзима, расщепляющую пектин на его олигомеры (Михайлова и др., 1982).
Относительно степени адаптивности пектолитических энзимов единодушного мнения пока нет и они в этом отношении еще недостаточно изучены. Полигалактуроназа рассматривалась первоначально как конститутивный энзим (Gaumann, 1949), что, видимо, подтверждается и для Penicillium chrysogenum, хотя пектинметилэстераза у него адаптивна. Однако у дереворазрушающих грибов ПГ адаптивна и резко стимулируется на средах с пектином (Lyr, 1959, 1960). Точно так же оказываются адаптивными энзимы этого типа у Aspergillus niger (Фениксова, Молдабаева, 1967). По поводу ПГ Botrytis cinerea возникают значительные разногласия. Одни считают ее у всех видов Botrytis конститутивным (Талиева, Плотникова, 1962), другие находят, что ее образование стимулируется пектином, т. е., что она адаптивна (Ashour, 1954). У этого гриба, а также у Sclerotinia sclerotiorum декстроза даже на среде с пектином угнетала образование ПГ. Тоже касается ПГ Rhizoctonia solani, которая в одних работах фигурирует как конститутивная, в других - как адаптивная (Ayers, Papavizas, Diem, 1966), как и соответствующий фермент гриба Aphanomyces euteiches.
Пектинтрасэлиминаза (ПТЭ) у Rhizoctonia solani оказалась адаптивной, а у Pythium debarianum конститутивной. Единственный пектолитический энзим, найденный у Phytophthora infestans, - пектинметилэстераза оказалась конститутивной (Clarke, 1966).
Одновременное наличие у продуцента эндо- и экзоформ ПГ можно установить по непропорциональности между понижением вязкости и увеличением количества редуцирующих концевых остатков мономеров, что особенно выявляется в случае наличия одной эндоформы энзима. У грибов встречаются и те и другие формы фермента, в частности у дрожжей. У дереворазрушающих грибов - трутовиков установлена экзо-ПГ (Lyr, 1959; 1963),. у Neurospora - эндо-ПГ, так же как и у Aphanomyces euteiches. При исследовании ПГ в конидиях Colletotrichum orbiculare как: эндо-, так и экзоформа ПГ показали более высокую активность в их матриксе, чем в нативном материале, что говорит о поверхностной локализации их в клетках.
Пектинолитические энзимы грибов встречаются в самых разнообразных сочетаниях, хотя наиболее часто обнаруживается у них полигалактуроназа, найденная в спорах ржавчины Puccinia. glumarum, P. triticina и P. suaveolens (Талиева, Плотникова, 1962), у дрожжей, Botrytis cinerea, Penicillium chrysogenum, Neurospora crassa и Aphanomyces euteiches. В сочетании с протопектиназой она была обнаружена в спорах Aspergillus niger и у трех видов Botrytis - В. cinerea, В. anthophita и В. attii, а также у Sclerotinia sclerotiorum и в сочетании с пектинметилэстеразой у Ceratocystis fimbriata и Verticillium dahliae, а с обоими этими ферментами (протопектиназой и ПМЭ) у Fusarium oxysporum f. vasinfectum (Васильева, Метлицкий, 1968). Без сопровождения другими пектолитическими компонентами протопектиназа была также найдена у Colletotrichum trifolii, пектинметилэстераза у Phytophthora infestans (Clarke, 1966) и Sclerotinia sclerotiorum, а пектинтрансэлиминаза у Rhizoctonia solani (Ayers et al., 1966) и Pythium debarianum.
Как можно видеть из этого перечня, пектолитические энзимы особенно обильны у паразитных грибов, поражающих корни растений или проникающих в них через корни. В этом отношении особое внимание привлекают два фермента: протопектиназа и пектинтрансэлиминаза. По материалам Талиевой и Плотниковой (1962), протопектиназа из трех видов рода Botrytis оказалась наиболее выраженной у форм с большей адаптацией к паразитизму (В. anthophila и особенно В. allii) по сравнению с сапротрофным В. cinerea, что авторы связывают с транспортной, т. е. способствующей проникновению в растение функцией этого фермента. Вторым ферментом транспортного назначения, вероятно, окажется, специально для обитателей аридных (пустынных) щелочных почв, пектинтрансэлиминаза с ее оптимумом эффекта при рН около 8,0, очень близким к рН почвенного раствора этой зоны. Ферменты типа ПГ и ПМЭ с оптимумом действия при рН, близким к кислотности клеточного сока растений (от 4,0 до 5,0), вероятно, несут скорее "трофическую функцию" (по терминологии Талиевой) и шире всего представлены у почвенных сапротрофов и грибов дереворазрушителей, что вполне соответствует занимаемой ими экологической нише.
Пектолитические ферменты грибов получают все большее практическое значение и широко изучаются в этом плане (Банфилд, 1963). Известно, например, что мощный пектолитический комплекс возбудителя так называемой "благородной гнили винограда", В. cinerea, успешно использовался для осветления дессертных вин яри их созревании. Для стабилизации вин и при приготовлении фруктово-ягодных вин и соков пектолитические ферменты стали применять и в Советском Союзе, например, при изготовлении вин из крыжовника или черной смородины (Датунашвили и др., 1976; Кишковский и др., 1974), однако значение их для промышленности этим не исчерпывается. Они оказались очень полезными при обработке различных растительных продуктов, например при экстракции крахмала, витаминов, лекарственных веществ, при осахаривании сельскохозяйственных отходов или при заготовке кормов в животноводстве, в связи с чем в последнее время очень повысился интерес к изучению именно этого класса ферментов.
В поисках полезных для различных целей продуцентов пектолитических ферментов были обследованы разнообразные роды грибов, например 340 штаммов у 38 видов рода Penicillium и 132 штамма у 13 видов Fusarium (Айзенберг, Билай, 1970; Девдариани и др., 1982), Trichoderma koningii (Fanelli et aL, 1978) и ряд базидиомицетов, например трутовики Fomitopsis cytisina и Irpex iacteus (Kawai et al., 1978). В ряде из этих работ выяснилось, что наибольший эффект в отношении мацерации растительных тканей дает, как и в случае целлюлаз, применение комплекса ферментов. Так, например, совместное применение полиметилгалактуроназ (ПМГ) и пектинтрансэлиминазы (ПТЭ) из Penicillium digitatum для мацерании тканей листа и клубня картофеля можно объяснить их различной активностью в отношении пектинов разного происхождения. Эндо-ПМГ P. digitatum лучше всего гидролизовала свекловичный и лимонный пектины, экзо-ПМГ - свекловичный и лектовую кислоту, а ПТЭ - яблочный и не действовала на пектовую кислоту. Вероятно, при этом играло роль не только сродство ферментов к разным пектинам, но и различия в оптимальных для их действия рН, которые имеют значения для экзо-ПМГ - 4,5, для эндо-ПМГ - 5,0, а для ПТЭ - 9,0 (Михайлова и др., 1982). Пектолитические ферменты P. digitatum угнетаются ионами тяжелых металлов, как Fe2+, Ag+, Pb2+, Zn2+, Cu2+, и натрия, а также редуцирующими, поверхностно-активными и хелатообразующими веществами. Эндо-ПМГ несколько активируются ионами Са2+, а экзо-ПМГ - Mg2+ и Аl2+.
Изучались также пектолитические ферменты, образуемые неуказанными авторами видами родов Penicillium и Fusarium, которые наилучшим образом очищались при помощи осаждения их ацетоном из сконцентрированной культуральной жидкости после роста грибов на среде со свекольным жомом (Давдариани и др., 1982). Полученный пектолитический комплекс содержал три пектолитических фермента в препарате из Penicillium и четыре в препарате из Fusarium с оптимальными рН 4,5 и температурой 40°С для активности препарата из Fusarium и рН 5,0 и температурой 50°С для активности препарата из Penicillium. В полученном препарате из Fusarium преобладали экзо-ПГ и эндо-ПГ, в препарате из пеницилла - пектинметилэстераза. ПТЭ была обнаружена только у Fusarium, и, кроме того, в обоих препаратах имелась большая примесь кислой протеазы и незначительная целлюлаз.
С позиций определения роли пектолитического комплекса энзимов в фитопатологии изучались также ферменты возбудителя вилта хлопчатника, Verticillium dahliae, у которого были обнаружены ПГ, накапливающиеся при низком рН среды (5,5), и ПТЭ, синтезирующаяся при более высоком (рН 7,0-7,5). Оптимум роста и формирования ПТЭ был обнаружен при температуре 28-30°С. Влияние на заболевание вилтом метеорологических факторов авторы связывают с тормозящим влиянием температуры выше 30°С на образование патогеном ПТЭ (Согдиева, Васильева, 1975).
Поскольку мацерация растительных продуктов зависит не только от пектолитического комплекса, а часто от дополняющих их целлюлаз и протеаз, комплексные смеси, подобные получаемым Девдариани с сотр. (1982), оказываются более действенными, чем индивидуальные энзимы. Однако возможен и другой подход к этой практической проблеме. Помимо использования естественно синтезирующихся продуцентов смесей гидролитических энзимов применяются также препараты, составленные путем смешивания полученных от разных продуцентов или путем последовательного экспонирования мацерируемого материала в ряде таких энзимов. Одна из таких процедур была разработана при мацерации листьев растений путем чередования обработки сначала пектофоетидином ТОХ и затем целлюлазой из термотолерантного штамма Aspergillus terreus (Логинова и др., 1980). Удобный для такой мацерации комплекс энзимов, содержащий целлюлитические, пектолитические энзимы, глюканазы и ксиланазы, был обнаружен у Fomitopsis cytisina и Irpex lacteus (Kawai et al., 1978; Noguchi et al., 1978), причем последний трутовик продуцировал также значительное количество протеиназы, что делало его пригодным и для целей пищевого производства (Suga et al., 1978). Ранее, для целей переработки кормов для сельскохозяйственных животных, исследовался также состав энзимного комплекса, образуемого трутовиком Тrаmetes sanguinea, который оказался продуцентом протеазы, целлюлазы, глюканазы и пектиназы при росте в погруженной культуре.
Исследование семи энзимов (протеазы, целлюлазы, гемицеллюлазы, амилазы, лакказы, каталазы и пероксидазы) плодовых тел 334 базидиальных и сумчатых макромицетов и их изозимов при анализе с помощью электрофореза в геле оказалось полезным для целей хемотаксономии (Lamaison, 1976).
Хитиназа несколько отличается от других карбогидраз тем, что она гидролизует азотсодержащее соединение - хитин. Однако ее целесообразно рассматривать вместе с ними, так как хитин по своей структуре идентичен полисахаридам и отличается от них лишь тем, что составляющие его мономеры представляют собой ацетильные производные глюкозамина. Хитиназа гидролизует хитин до ацетилглюкозамина и широко распространена у грибов. Ее можно обнаружить в плодовых телах базидиомицетов, как Coprinus comatus, Phallus impudicus, Fistulina hepatica, и особенно у видов дождевиков Bovista и Lycoperdon. Этот энзим относительна термостабилен и активируется белком сыворотки крови. Появились также сообщения о другом ферменте, свойственном мицелиальным грибам (например, Mucor rouxii), способном деацитилировать хитин с образованием хитозана.
Хитиназа является одним из основных компонентов комплекса, составляющего улиточный фермент, используемый в экспериментальной микологии для получения сферопластов грибов, лишенных клеточной оболочки. Из 35 видов грибов, исследованных в отношении образования подобного комплекса ферментов, были отобраны Coprinus macrorhizus f. microsporus, C. radians, С. micaceus, Daedaliopsis styracina и Irpex lacteus (Kawai, 1970). Наиболее активные продуценты этого комплекса, содержащего глюканазы, маннаназы, хитиназу, целлюлазы и протеазу, - Coprinus macrorhizus f. microsporus и С. radians - были способны гидролизовать протеины, глюканы, маннаны и хитин.
Активно гидролизующий хитин дождевик - Lycoperdon perlatum - образует энзимный комплекс, растворяющий оболочки дрожжей (Musilkova et al., 1975 а, б). Препарат этого комплекса как из природных плодовых тел, так и из энзимного концентрата, полученного при росте мицелия в погруженной культуре, полностью заменяет энзиматически активный препарат из улитки Helix pomatia.
Ферменты, участвующие в синтезе олиго- и полисахаридов, относятся к синтетазам и включают обычно в качестве кофакторов уридиловые, реже гуаниловые нуклеотиды. При исследований, хлорнокислых экстрактов из мицелия грибов в них обычно обнаруживается при хроматографическом разделении большое количество таких нуклеотидов, как уридиндифосфатглюкоза (УДФГ) и уридиндифосфатацетилглюкозамин (УДФАГ), - переносчиков мономеров глюкозы и ацетилглюкозамина (Крицкий, 1965; Мансурова, 1966).
Синтетаза специфичного для грибов дисахарида трегалозы или микозы с рациональным названием УДФ-глюкозо-D-глюкозо-6-фосфат-1-глюкозилтрансферазы была обнаружена у гриба-слизевика Dictyostelium discoideum. Количество этого фермента особенно нарастало у Dictyostelium к моменту образования у него плодовых тел (Roth, Sussman, 1966).
Дубильные вещества, в том числе и таннин, представляют собой глюкозиды кислот, являющихся производными полифенолов, в особенности галловой кислоты, содержащей три гидроксильные группы и карбоксил в параположении к средней из них (рис. 6.12). При гидролизе ферментом танназой таннин присоединяет воду и расщепляется на галловую кислоту и сахара (Фостер, 1950). Танназа была открыта Ролленом еще в 1860 г., а продуцент ее Aspergillus niger, обнаруженный при брожении галловых орешков, был описан Ван Тигемом в 1867 г. Танназу образуют многие грибы, особенно связанные тем или иным образом с богатыми дубильными веществами широколиственными породами деревьев. Но наиболее активен среди ее продуцентов A. niger. Это адаптивный энзим, образующийся в присутствии в среде таннина или галловой кислоты. Однако дополнительная добавка в среду до 10% сахара не только не снижает активности этого фермента, но и направляет деятельность гриба исключительно на гидролиз таннина, предохраняя от дальнейшего потребления им образующуюся галловую кислоту (Фостер, 1950).
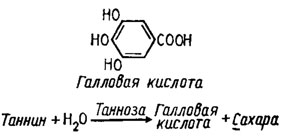
Рис. 6.12. Формула галловой кислоты и реакция гидролиза таннина танназой
Ферменты, расщепляющие таннин и фенолы, часто встречаются у грибов, паразитирующих на древесных растениях. К их числу относится паразит, встречающийся на коре деревьев, Endothia parasitica, поражающий их корни Trametes radiciperda (Fomitopsis annosa), и паразит, обитающий на хвое, Herpotrichia nigra. Изученная достаточно подробно Endothia parasitica продуцирует два энзима: 1) эстеразу, расщепляющую эфиры галловой кислоты и танннны, 2) пирогаллазу, фермент типа оксидаз, разрушающий галловую кислоту и гидрохинон. Ингибиторами этих ферментов оказались 10%-й раствор глюкозы и гидрохинон. Наличие у паразитных грибов ферментов этого типа приводит к тому, что многие растения, богатые токсическими для грибов дубильными веществами, оказываются неустойчивыми к таким патогенам.
Эстераза, сходно с танназой расщепляющая глюкозиды, была обнаружена у гриба Coniothyrium diptodiella и получила название нарингиназы, исходя из ее способности расщеплять нарингин, глюкозид, содержащийся в оболочках плодов цитрусовых и обусловливающий горький вкус сока грейпфрута. Этот фермент, который мог бы найти применение для улучшения вкуса соков цитрусовых, оптимально активен при рН 4,2 и при 60-65°С. При 70°С он инактивируется в течение 30 мин, но относительно стабилен при обычных температурах в пределах рН от 4,0 до 6,0. Как и действие танназы паразитных грибов, его активность ингибируется в присутствии в среде Сахаров.
Протеолитинеские и фибринолитические ферменты. К числу гидролаз относятся также протеолитнческие ферменты грибов, которыми они снабжены весьма обильно (Андеркофлер, 1963 а), так как они способны широко использовать для питания разнообразные белки и пептиды. Гидролизующие белки энзимы относят к категории протеиназ, гидролизующие пептиды - к категории пептидаз. Отличие пептидаз от протеиназ состоит в их способности отщеплять только концевые остатки аминокислот, в результате чего продуктами гидролиза оказываются только аминокислоты, но не пептиды, как в случае протеиназ. Различаются эти ферменты также и по оптимальным для их действия уровням рН: различают ферменты типа пепсинов, активные в кислых диапазонах рН, и типа трипсинов, связанные с более щелочными условиями среды. В наличии протеолитических ферментов у грибов можно убедиться, при анализе результатов их изучения в мицелии Penicillium chrysogenum, получаемом при ферментации пенициллина (Маттисон, 1956), и Aspergillus oryzae, выращиваемом с целью получения комплекса амилолитических и протеолитических ферментов для применения их в пищевой промышленности (Движение, Савицкайте, 1969). Более подробный анализ показал, что в этот комплекс входят следующие энзимы: 1) протеиназы с оптимальной активностью при рН 5,0-6,5, расщепляющие альбумин и казеин; 2) пептидаза типа триптаз, отщепляющая концевые аминокислоты при рН 7,0-7,5; 3) пептидаза, проявляющая активность при рН 8,0-8,4. Две последние расщепляют желатину и пептон (Маттисон, 1956). Все эти ферменты способны пептонизировать коллаген кожи.
В препарате из мицелия Aspergillus oryzae, оризине ПК, с помощью разделения на сефадексе G-100 были обнаружены три. фракции протеаз, а при разделении на сефадексе А-50 - пять фракций (Движение, Савицкайте, 1969), которые различались по их действию на казеин, гемоглобин и синтетические субстраты. Судя по данным дискового электрофореза, они были составлены различными белками. Среди них были обнаружены два энзима с оптимальной активностью в кислом (рН 4,5 и 5,0) и два - в щелочном диапазоне (рН 7,0 и 10,0), и они различно реагировали на соли Са2+, Mn2+ Cu2+, Ni2+ Co2+ Zn2+ Hg2+ Cd2+. Кислые протеазы теряли активность в присутствии детергента, ЭДТА и цистеина. Другие разнообразные грибы при их изучении также обнаруживали протеолитическую активность, например корневая губка Fomitopsis annosus.
К протеолитическим ферментам близки по свойствам кератинолитические, объединяемые под названием кератиназы, способные гидролизовать кератин шерсти, рога, волос и перьев. Отличие их от протеолитических энзимов состоит в том, что они, вероятно, способны энергично воздействовать на дисульфидные спайки, особенно многочисленные в кератине.
Кератинофильные грибы довольно часто выделяются из некоторых почв (Шатин, 1964), и среди них встречаются как типичные дерматофиты, например Microsporium gipseum и M. cookei, так и сапротрофы вроде Karatinomyces ajelloi. Сюда же, видимо, относятся встречающиеся нередко в почвах горных пастбищ Средней Азии виды Sporotrichum. Кератинолитической способностью обладают патогенные для человека и животных дерматофиты, а также обнаруживающийся на шерстепрядильных фабриках в обстановке высокой влажности Myrothecium verrucaria, являющийся разрушителем шерсти в условиях производства. Механизм действия и свойства ферментов этой категории пока, видимо, недостаточно изучены.
Одну из важнейших категорий протеолитической группы энзимов в связи с их медицинским значением представляют собой фибр инолитические энзимы. Фибринолитические ферменты грибов, еще в 60-х годах привлекли внимание исследователей ввиду возможности их применения для консервативного лечения тромбоэмболических и других заболеваний, связанных со свертыванием крови. По своей природе и типу действия эти ферменты близки к трипсину и к другим ферментам типа протеиназ, но многие из них, обладая слабой казеинолитической способностью, высокоактивны в отношении гидролиза фибрина, а некоторые одновременно стимулируют активность фибринолитических систем крови. К последним относятся стрептокиназа, получаемая из Streptococcus haemolyticum, и трихолизин - из гриба Trichothecium roseum, тогда как обладающие фибринолитическим действием, но неизвестные как активаторы фибринолиза в организме животного энзима выделялись преимущественно из видов рода Aspergillus.
Идея использования ферментов грибов для ликвидации тромбов и эмболии, по-видимому, принадлежит Стефанини, получившему первый инъекционный препарат этого типа "Аспергиллин О" из Aspergillus oryzae, представляющий собой нейтральный белок, осаждающийся солями тяжелых металлов (Cu2+, Zn2+, Cd2+). Сходный препарат из штамма того же вида гриба был получен в Советском Союзе (Кудряшов и др., 1963; Егоров, Ландау, 1965). Термолабильный препарат из А. orysae, названный аспергиллином (Струкова, 1965), отличался от выделенной из него несколько ранее аспергиллопептидазы В по оптимальному значению рН, типу действия, молекулярной массе и аминокислотному составу. Еще сильнее отличалась от них аспергиллопептидаза А, выделенная из Aspergillus saitoiy оптимально действующая в сильнокислой зоне (рН 2,5-3,0) и способная активировать трипсиноген и химотрипсиноген. Ее субстратная специфичность была шире трипсина, и она представляла собой одноцепочечную структуру с С-концевой группой серина и С-концевой группой аланина с дисульфндной связью. Кроме названных из числа фибринолитических ферментов видов рода Aspergillus, относительно хорошо изученных, необходимо отметить террилитин из А. terricola (Имшенецкий и др., 1965; Имшенецкий, Броцкая, 1967; Самсонов и др., 1972) и браназу из А. ochraceus. Оба этих фермента очень сходны по молекулярной массе и аминокислотному составу и характеру их действия на фибрин и другие белки, но отличаются по оптимальному для их активности рН и их изоэлектрической точке. Из выявленных спектрофотометрически по пикам поглощения двух компонентов террилитина (Коршунов, 1965, 1969) основной компонент (с оптимальной активностью при рН 8,0-10,0) представляет собой нейтральную протеазу, активируемую солями Сu2+ и Zn2+ в концентрации 10-2, с небольшой примесью кислой (оптимальный рН 5,0) (Самсонов и др., 1972). Браназа, очищенная с помощью хроматографии на DEAE-сефадексе (Topfer, Pischer, 1974), имеет оптимальный уровень рН 7,8-8,0, активируется и стабилизируется ионом Са2+ (Roschbau, Ives, 1974).
Близкий к этим ферментам по молекулярной массе трихолизин из Trichothecium roseum сильно отличается от них по аминокислотному составу и типу действия, сходному с действием стрептокиназы. Помимо фибринолитической способности он активирует in vitro и in vivo плазминоген кровн (Андреенко и др., 1968; Andreenko et al., 1974). Трихолизин представляет собой сложный комплекс, содержащий свыше пяти активных компонентов. Контроль с помощью электрофореза в полиакриламидном геле выявил после разделения изоэлектрофокусированием только одну индивидуальную нейтральную фракцию IV с оптимальным для активности рН в пределах между 8,5 и 9,0, которая была изучена наиболее подробно, почти лишенную казеннолитической активности, но с высоким фибринолитическим и активирующим плазминоген эффектом. Все остальные фракции с ИЭТ от 3,7 до 10,0 также были способны к фибринолизу, хотя и с большей примесью казеинолитического действия, и содержали по 2-3 компонента, но оптимальное рН лежало для всех в одном диапазоне от 8,0 до 9,0 (Степанова, 1977).
Довольно глубоко изученным оказался также протеолитический и фибринолитический фермент из Torula thermophila с оптимальным для его активности рН в нейтральной и щелочной зоне и концевой группой глицина (Караваева, Мухитдинова, 1976; Мухитдинова, Караваева, 1976). Фибринолитическая и протеолитическая активность была также найдена у ферментов двух видов рода Penicillium пептидазы А из P. janthinellum с молекулярной массой 32000 и оптимальной активностью при рН 3,0-4,0 (Hoffman, Sham, 1964; Shaw, 1964) и термолабильной протеазы из P. lilacinum с фибринолитическим эффектом в широком диапазоне рН от 4,0 до 11,0, являющейся комплексом металлоэнзимов с различной молекулярной массой (Андреева и др., 1972, 1973; Егоров и др., 1972).
Способность активно продуцировать протеолитические ферменты у грибов очень развита, что можно видеть из исследований (Егоров и др., 1971; Прудлов и др., 1972), в которых была обнаружена эта активность у 48 штаммов из полученных 59 (около 81%), относящихся к родам Cladosporium, Fusarium и Alterneria. При этом протеазы из Fusarium solani, F. graminearum, Alternaria geophila и Alternaria sp. 62 представляли собой комплексы ферментов с фибринолитической и тромболитической активностью в нейтральной и щелочной зонах рН (Егоров и др., 1972).
Из приведенного здесь перечисления можно видеть, что микромицеты являются очень перспективными источниками фибринолитических ферментов для применения в медицине. Они слабо токсичны и многие из них (трихолизин, террилитин, браназа и аспергиллин) проходят в настоящее время клинические испытания, а "Аспергиллин О" давно уже является промышленным препаратом, применяемым в медицине США.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'