
1. Ферменты фосфорного обмена
Ферменты фосфорного обмена представляют собой особенно важную категорию катализаторов обмена веществ, поскольку они обеспечивают формирование и передачу запасов энергии в форме макроэргических фосфорных связей почти для всех процессов биологического синтеза в клетке, являясь агентами запасания энергии для этих синтезов, источником которой служит окислительное фосфорилирование. Ферменты, участвующие в этом метаболизме, очень разнородны по их химическому действию, так как их можно причислять к категориям трансфераз, оксидоредуктаз и эстераз.
Для понимания способа действия и назначения этих ферментов полезно рассмотреть принцип работы механизмов образования и. использования энергии макроэргических фосфорных связей (-О-Р-О-Р-О-). Образованию таких связей, как правило, предшествует получение энергии за счет окисления, которое осуществляется один (в цикле ЭМП) или два раза (в цикле ГМФ) в гликолитическом шунте и не менее четырех раз в цикле трикарбоновых кислот. В процессе гликолиза для окислительного фосфорилирования используется энергия, получаемая при окислении 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, макроэргический фосфат которой переносится затем, при трансформации ее в 3-фосфоглицериновую кислоту, на АДФ, трансформирующийся при этом в АТФ (рис. 6.2). Аналогичный процесс протекает в пределах цикла трикарбоновых кислот, например, при образовании сукцинил коэнзима А и трансформации его в янтарную кислоту (рис. 6.3).
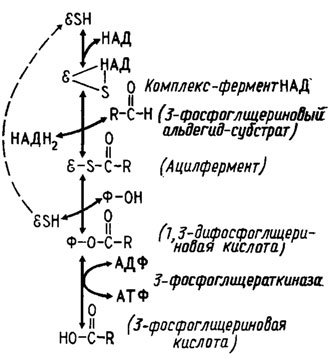
Рис. 6.2. Механизм фосфорилирования, сопряженный с окислением фосфоглицерииового альдегида в 1,3-фосфоглицериновую кислоту: Е - энзим (дегидрогеназа); Ф - фосфат (Девис и др., 1966)
Помимо ферментов, относящихся к НАД и флавиндегидрогеназам, обеспечивающих этап получения энергии путем окисления, в этих процессах принимают участие энзимы, переносящие неорганический фосфат (ацилирующие), осуществляющие дальнейшее перемещение фосфата на АДФ, киназы, фосфотрансферазы, переносящие фосфорные группы с одного углевода на другой или с одного атома углерода на другой. В этапе использования энергии фосфорных связей на синтезы участвуют фосфатазы, отщепляющие неорганический ортофосфат или пирофосфат, а субстратом для этого процесса могут служить как нуклеотиды (например, АТФ), так и обильные у грибов полифосфаты (см. вторую главу).
Как при использовании донора энергии АТФ, так и полифосфатов, запасание и расходование энергии фосфорных связей распадается на два этапа: образование этих связей и их расщепление. Первый этап осуществляется с помощью ацилирующих энзимов, содержащих SH-группы (в частности, в форме КоА). В качестве кофермента фосфогексокиназы, переносящей фосфор при фосфорилировании моносахаров, известен рибофлавин. Второй этап - расщепление фосфорных связей с образованием ортофосфата - осуществляется фосфатазами, которые в связи с их использованием для аналитических целей изучались довольно подробно.
Эти ферменты применяются, в частности, для отщепления фосфата от тиаминпирофосфата при анализе тиамина и расщеплении фосфорилированного НАД при анализе витамина PP. Фосфатазы относятся к эстеразам, гидролизующим эфиры фосфорной кислоты. Сюда относят ферменты, гидролизующие эфиры фосфорной кислоты с углеводами, глицерофосфатазу, апиразу, расщепляющую АТФ, пирофосфатазу, метафосфатазу и другие полифосфатазы. У грибов полифосфатаза впервые была найдена Манном у Aspergillus niger.
В дальнейшем, при изучении этого типа энзимов у Penicillium chrysogenum, были найдены апираза, расщепляющая АТФ, пирофосфатаза и метафосфатаза, которые все подавлялись ионами кальция, цинка и магния при рН от 3,0 до 5,0, а также фторидами и азидом. Глицерофосфатаза P. chrysogenum изучалась Садасиваном, который обнаружил, что их имеется две (Sadasivan, 1965): щелочная с оптимальным рН от 8,0 до 9,0, содержащая магний и цинк, и кислая с оптимумом действия в кислом диапазоне рН. Щелочная фосфатаза сильно угнеталась синильной кислотой и кальцием и реактивировалась магнием и цинком, кислая реагировала на синильную кислоту значительно слабее.
У некоторых плесневых грибов, а именно у Penicillium lilacinum, Aspergillus oryzae, А. niger и Rhizoctonia violacea, фосфатаза образовывалась и даже стимулировалась при недостатке магния в среде. Однако при введении в среду возможного конкурента магния - бериллия - у испытанных видов рода Aspergillus наблюдалось подавление синтеза этого фермента, хотя у других двух видов - P. lilacinum и R. violacea - на первых стадиях развития его активность усиливалась.
Фосфатазы проявляют высокую активность в процессе деления клеток, что было отмечено как для процессов редукционного деления на примере базидиомицета Clavatia cyatiformis (Blumer, Li-Yu-Теn, 1966), так и для обычного кариокинеза у целого ряда паразитных и сапротрофных грибов.
При рассмотрении фосфорного обмена у высших эукариот, растений и животных основное внимание уделяется реакциям, в которых принимает участие как донор фосфора и энергии аденозинтрифосфат. Однако низшие эукариоты (грибы, водоросли, протисты) и прокариоты (бактерии, актиномицеты и цианобактерии) имеют и другие, видимо, еще более значимые для их метаболизма, чем АТФ, доноры фосфора и энергии, а именно пирофосфат и неорганические высокополимерные полифосфаты. Поэтому ферменты гримов, имеющие отношение к их обмену, заслуживают специального рассмотрения (Кулаев, 1975).
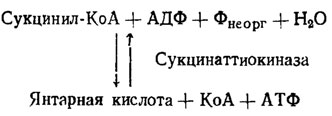
Такие ферменты делятся на две категории: 1) имеющие отношение к их биосинтезу и 2) функционирующие при их использовании на нужды обмена веществ. Известны два фермента, производящие наращивание цепи полифосфатов на один фрагмент, а именно полифосфаткиназа и 1,3-дифосфоглицерат-полифосфаттрансфераза (ДФГК/рис. 6.4). Полифосфаткиназа наращивает полифосфатную цепь на один фрагмент за счет трансформации АТФ в АДФ. Однако направление действия полифосфаткиназы в сторону синтеза полифосфата известно только у бактерий, тогда как грибы (Aspergillus niger, Saccharomyces cerevisiae) способны только к необратимой реакции переброса фосфорной группы с полифосфата на АДФ, т. е. насыщению фосфором пула АДФ → АТФ. У ряда грибов (Neurospora crassa, Penicillium chrysogenum) не было обнаружено даже в этой реакции. Напротив, у всех исследованных бактерий она существовала и была обратимой, хотя и здесь, судя по максимальному развитию этой активности в конце онтогенеза бактерий, его основная роль приурочена к моменту максимального расхода полифосфатов и обогащения пула АТФ (Кулаев, 1975).
Рис. 6.4. Реакции полифосфат-синтезирующих ферментов у бактерий и грибов (Кулаев, 1975)
Второй фермент, 1,3-дифосфоглицератполифосфаттрансфераза (ДФГ-ПФК), наращивающий полифосфатную цепь за счет переноса фосфата с 1,3-дифосфоглицериновой кислоты, был найден первоначально у аденин-дефицитного мутанта Neurospora crassay но затем и у дикого штамма этого гриба, у Penicillium chrysogenum и у ряда бактерий и актиномицетов. При наличии альдолазы субстратом действия этого фермента может служить также и 1,6-фруктозодифосфат. Он ингибируется известными ингибиторами гликолиза по пути ЭМП как монойодуксусная кислота или смесь фторида и арсенита, что говорит о тесной связи этого пути биосинтеза полифосфатов с циклом ЭМП. О том же говорят данные цитохимических исследований онтогенеза грибов, подтверждающие связь у них синтеза полифосфатов с этим путем обмена (Дмитриева, Беккер и др., 1962). Судя по максимальной активности этого фермента в период наиболее интенсивного наращивания пула полифосфатов, именно он, а не полифосфаткиназа является наиболее вероятным агентом биосинтеза полифосфатов.
На основе первых изотопных исследований предположили, что различные фракции полифосфатов образуются за счет деградации полифосфатдеполимеразами первично синтезированных наиболее высокомолекулярных фракций, что, в общем, соответствует истину хотя, возможно, объясняется локализацией этих деполимераз в зоне действия синтезирующих полифосфаты ферментов в области клеточной мембраны и зоны поступления из среды ортофосфата. Однако позднее было обнаружено, что эти фракции могут синтезироваться и независимо друг от друга. Например, у базидиомицета Lentinus tigrinus и аскомицета Neurospora crassa была обнаружена корреляция накопления солерастворимой фракции полифосфатов (ПФ2) с биосинтезом РНК и ДНК на уровне коэффициента корреляции, равном 0,88. Подтверждение объяснения этого явления было получено при исследовании на Schizosaccharomyces роmbе.
Максимум активности предположительно участвующей в снабжении энергией биосинтеза полифосфатов пирофосфатазы опережает максимум накопления нуклеиновых кислот и ПФ2 фракции (рис. 6.5). Предположительная схема этого процесса приводится на рис. 6.6.
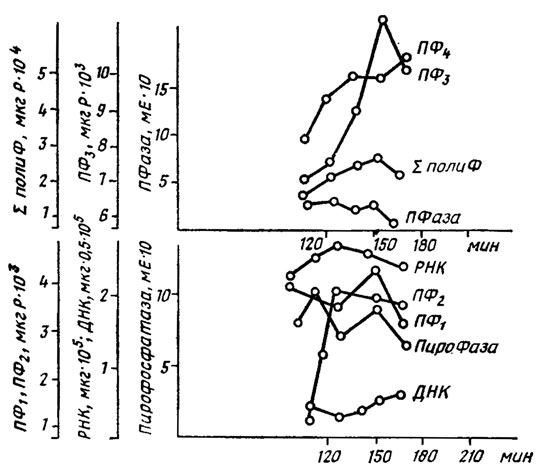
Рис. 6.5. Динамика изменения содержания нуклеиновых кислот, полифосфатовг полифосфатфосфогидролазы (ПФаза) и пирофосфатазы (ПироФаза) у Schizosaccharomyces pombe. ПФ1 и ПФ2, - кислоторастворимые и солерастворимЫе полифосфаты; ПФ3, ПФ4 и ∑ПолиФ - щелочерастворимые, растворимые в горячей хлорной кислоте и сумма всех полифосфатов (Кулаев, 1975)
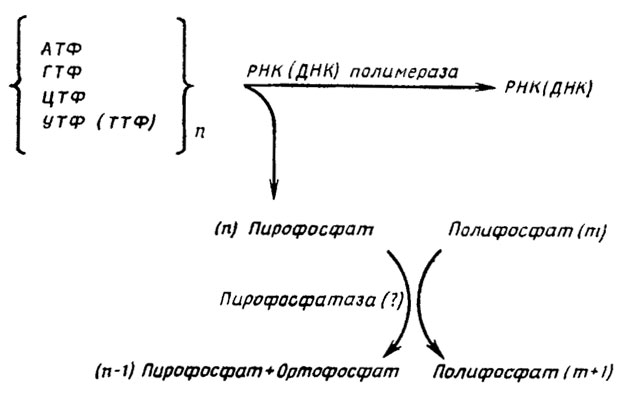
Рис. 6.6. Схема сопряженного синтеза полифосфатов и биосинтеза РНК и ДНК (Кулаев, 1975)
Сходный механизм с участием той же пирофосфатазы предположительно объясняет корреляцию накопления фракции полифосфатов ПФ3 с синтезом маннана, компонента оболочки дрожжей Saccharotnyces carlsbergiensis (рис. 6.7).
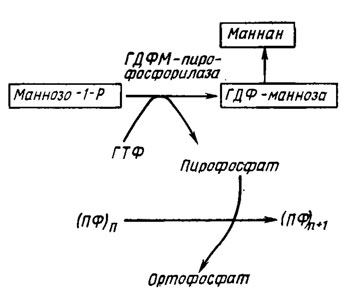
Рис. 6.7. Схема, объясняющая корреляцию накопления полифосфатов у Saccharomyces carlsbergiensis (Кулаев, 1975)
Необходимы ли для синтеза полифосфатов какие-либо матричные основы или затравки пока неясно, но есть данные, что для него требуются затравки в форме три-, тетра- и других полифосфатов. Существенно, что вторичный синтез полифосфатов действительно имеет место у грибов, локализуясь в местах усиленного биосинтеза (клеточная мембрана, ядро) с использованием энергии и ортофосфата от расщепления освобождающегося при этих биосинтезах пирофосфата.
Низкополимерные пирофосфаты могут образовываться путем следующих реакций, характер которых показан в табл. 6.1. При этом триполифосфаты могут "быть продуктом действия деполимераз, синтезироваться из пирофосфата и фрагмента фосфорной кислоты, отщепляемого от АТФ, быть продуктом отщепления трехфрагментного остатка фосфатов от нуклеозид трифосфата, получаться при образовании из АТФ и метионина S-аденозилметионина и, наконец, образовываться в процессе биосинтеза витамина В12. Для биосинтеза тетраполифосфата (см. табл. 6.1) известна реакция, основанная на разрыве циклической структуры триметафосфата с включением в полученную цепь одного фрагмента ортофосфата (Кулаев, 1975). Реакция трансформации циклического полифосфата в линейный была обнаружена у дрожжей.

Таблица 6.1. Способы образования триполифосфатов и тетраполифосфатов (Кулаев, 1975). Образование триполифосфатов:
Таким образом, значительную роль в биосинтезе полифосфатов играет пирофосфат, образование которого у грибов может быть результатом не только процессов биосинтеза нуклеиновых кислот или полисахаридов, но и еще ряда реакций (табл. 6.2). Суммарная реакция состоит в сочетании между собой соединений А и В с потерей первым из них пирофосфата, отщепление которого сопровождается выделением энергии, необходимой для этой реакции. К производящим подобные реакции ферментам относятся нуклеотидилтрансферазы, ацилирующие нуклеозидтрифосфаты с образованием нуклеозидмонофосфатов аминокислот, Сахаров или фрагментов жирных кислот, и фосфорибозилтрансферазы, переносящие 5'-фосфорибозильную группу на различные азотистые основания.

Таблица 6.2. Пути образования пирофосфата у грибов (Кулаев, 1975)
Кроме того, у дрожжей описана третья реакция, также дающая в качестве конечного продукта пирофосфат и состоящая в отщеплении фосфорной группы от высокомолекулярного полифосфата, конденсирующейся далее с одной молекулой ортофосфата. Однако дальнейшая проверка наличия производящего такую реакцию фермента у Saccharomyces cerevisiae, Endomyces magnusii и Neurospora crassa не позволила подтвердить его существование.
Поскольку полифосфаты у грибов являются специализированными донорами фосфора и энергии для биосинтеза различных клеточных структур, в их обмене помимо синтезирующих имеют значение ферменты, производящие их деградацию и гидролиз. Уже упоминалось о роли в этих процессах полифосфаткиназы бактерий, переносящей фосфорную группу с АТФ на полифосфаты при их синтезе и обратно с полифосфатов на АДФ при их использовании. Первая реакция свойственна только бактериям, тогда как вторая обнаруживается также и у некоторых грибов.
На ферментах этого типа наиболее ярко обнаруживаются особенности биохимической эволюции грибов и прокариот (бактерий и актиномицетов), подтверждающие мнение о различном их происхождении и экологической конвергентности их морфологических признаков, например сходства спороношений грибов и актиномицетов. Так, помимо различно ведущей себя у грибов и бактерий полифосфаткиназы у бактерий и актиномицетов обнаружен отсутствующий у всех испытанных представителей грибов из классов сумчатых, базидиальных, дейтеромицетов и зигомицетов фермент полифосфатглюкокиназа, фосфорилирующий глюкозу за счет отщепления концевого фрагмента полифосфатов. Этот фермент имеет узкое значение даже для прокариот, так как обнаруживается только у их представителей, относимых Красильниковым к классу актиномицетов (актиномицеты, микобактерии, коринебактерии, пропионобактерии, микрококки и т. д.), что может говорить в пользу их самостоятельной филогении, происходящей от иного корня, чем у Eubacteria. Tо же относится и к таким переносящим фосфат ферментам, как полифосфатфруктокиназа, полифосфатманнокиназа и полифосфатглюконаткиназа, которые также встречаются только у бактерий (Кулаев, 1975).
У грибов, видимо, широко развита дифференцированная в отношении разных фракций полифосфатов система полифосфатаз, среди которых различают категорию полифосфатфосфогидролаз, экзоферментов, гидролизующих с отщеплением концевого остатка фосфорной кислоты с образованием ортофосфата и имеющих оптимум рН в нейтральной зоне (рН 7,1-7,5, табл. 6.3).
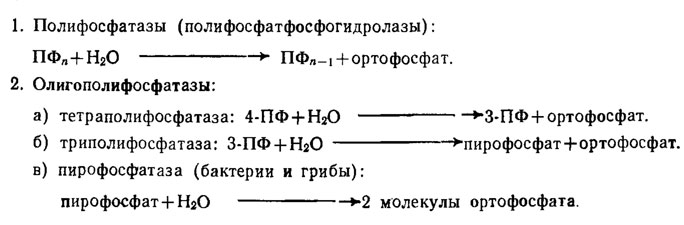
Таблица 6.3. Ферменты грибов и бактерий, расщепляющие полифосфаты (1 - полифосфатазы с оптимумом рН 7,1-7,5 / Кулаев, 1975)
К этой категории относятся: 1) полифосфатазы, гидролизующие высокомолекулярные пирофосфаты; 2) олигополифосфатазы, гидролизующие тетра-, триполифосфаты и пирофосфат. Ферменты этого типа, обнаруженные кроме бактерий у Saccharomyces cerevisiae, Endomyces magnusii и Neurospora crassa, обычно встречаются в форме комплекса. Так, среди комплекса ферментов этого типа у N. crassa выявляются одновременно присутствие полифосфатазы, триполифосфатазы, пирофосфатазы и АТФ-азы. Ферменты этой группы являются металлоферментами, стимулируемыми или: ингибируемыми двухвалентными катионами металлов, как это можно видеть на примере полифосфатгидролазы Е. magnusii на рис. 6.8. Однако действие катионов на активность этих ферментов у разных грибов оказывается различным. Так, фермент из N. crassa активируют магний, кобальт, марганец и железо, тогда как для фермента из Е. magnusii наиболее эффективны марганец и кобальт, а у дрожжей к магнию и кобальту добавляется никель, сильно угнетающий фермент N. crassa. Подобная разнохарактерность действия катионов наблюдается и при рассмотрении их ингибирующего влияния. Вероятно, вся эта пестрота эффектов зависит от катионов, действующих как на сам фермент, так и на субстраты реакции, с которыми они образуют комплексы, способствующие облегчению или угнетению степени аттакуемости связи -О-Р-О-Р.
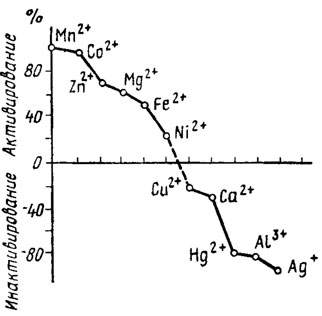
Рис. 6.8. Влияние катионов на активность полифосфатфосфогидролазы Endomyces magnusii (Кулаев, 1975)
Полифосфатазы грибов, как видно из табл. 6.4, локализуются в основном на поверхности клетки, близ локализации высокополимерных полифосфатов, вместе с которыми они вымываются из мембраны после обработки клеток улиточным ферментом.
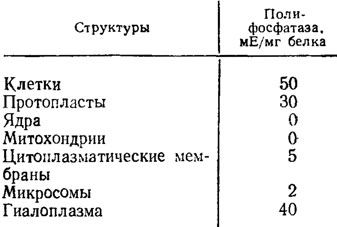
Таблица 6.4. Удельная активность полифосфатазы в клетках и их органеллах (Кулаев, 1975)
Вторая категория подобных же ферментов грибов представляет собой эндоформы или деполимеразы, расщепляющие цепи полифосфатов с образованием олигополифосфатов или полифосфатных цепей меньшей длины, чем исходная. Тип такой реакции показан в табл. 6.5, а результат ее обычно замеряется вискозиметрически. Ферменты этого типа характерны оптимумом в заметно кислой зоне рН (3,2-3,4). Они также активируются металлами, особенно цинком.
Полифосфатполифосфогидролазы.
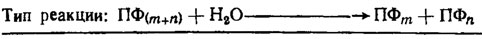
Таблица 6.5. Ферменты грибов, расщепляющие полифосфаты. Полифосфатдеполимеразы (полифосфатполифосфогидролазы) с оптимальным рН 3,2-3,4, встречающиеся только у грибов (Кулаев, 1975)
Локализация деполимераз еще в большей степени, чем у нейтральных полифосфатаз, привязана к поверхности клеточной мембраны, поскольку освобожденные от оболочки протопласты сохраняют их активность в размере порядка только около 0,1 от первоначальной (табл. 6.6). Есть основания предполагать, что эта категория энзимов может участвовать в переносе с поверхности клеточных мембран фрагментов синтезированных на них полифосфатов к другим клеточным структурам, работая таким образом как фосфотрансферазы. Регуляция действия всех описанных ферментов обмена полифосфатов очень сильно зависит от баланса соотношений полифосфатов и ортофосфата, являющегося основным механизмом, регулирующим направление их действия.
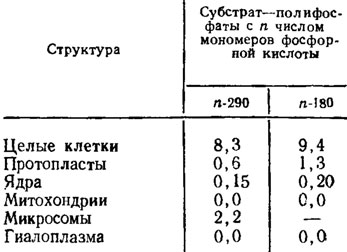
Таблица 6.6. Внутриклеточная локализация полифосфатдеполимеразной активности у Neurospora crassa в мЕ/мг белка (Кулаев, 1975)
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'