
Инструменты генных инженеров
"Человеческий инсулин синтезирован бактериями!". "Бактерии производят интерферон", "Вмешательство в основу жизни?" - это газетные заголовки последних лет, свидетельствующие о революции в биологии. Генная инженерия начинает целенаправленно изменять наследственный материал живых существ. Открытие, лежащее в основе важнейших методов генной инженерии, было сделано В. Арбером из Базеля в конце 50-х-начале 60-х годов. Он установил, что бактерии путем синтеза определенных ферментов пытаются защитить себя от поражения вирусами (бактериофагами). Эти бактериальные ферменты-эндонуклеазы рестрикции, или рестриктазы, разрезают ДНК вирусов, проникших в бактериальную клетку, на фрагменты и делают его таким образом неактивным. Десять лет спустя Г. Боуэр из Сан-Франциско показал, что изученная рестриктаза из бактерий кишечника Escherichia coli (названная поэтому Eco RI) разрезает ДНК всегда в строго определенных местах, то есть ее действие высокоспецифично. Для того чтобы понять, как протекает процесс "узнавания" и фрагментирования ДНК, остановимся вкратце на структуре молекул ДНК,
Молекула ДНК состоит из двух параллельных цепей, образующих спираль. Очень упрощенно ее можно представить в виде веревочной лестницы. Остов молекулы (канаты веревочной лестницы) образован остатками фосфатов и Сахаров. Четыре органических основания-аденин, тимин, цитозин и гуанин (сокращенно А, Т, Ц и Г) - образуют "ступеньки этой лестницы", причем таким образом, что А и Т с помощью водородных связей образуют одну ступеньку, а Ц и Г - другую. В последовательности ступенек (оснований ДНК) закодирована, упрощенно говоря, наследственная информация. Фермент Eco RI всегда разрезает обе цепи ДНК точно по одним и тем же основаниям, причем место фрагментации одной цепи смещено по отношению к другой на 4 пары оснований. При этом неровном разрезе возникают два выступающих конца. Образовавшись, они притягиваются друг к другу благодаря наличию "сломанных" водородных мостиков. Поэтому их называют "липкими концами". Другой фермент, ДНК-лигаза, может, расходуя АТФ, легко вновь соединить такие липкие концы. Если же с помощью тех же рестриктаз вырезать фрагменты из ДНК разных организмов, то все они будут иметь одинаковые, подходящие друг к другу липкие концы, которые в присутствии ДНК-лигазы можно соединить. В результате образуются гибридные молекулы из ДНК различных организмов. Таким образом, чужеродная наследственная информация "встраивается" в исходную ДНК, подобно тому как при создании фильма можно вырезать определенные сцены и вклеить на их место другие.
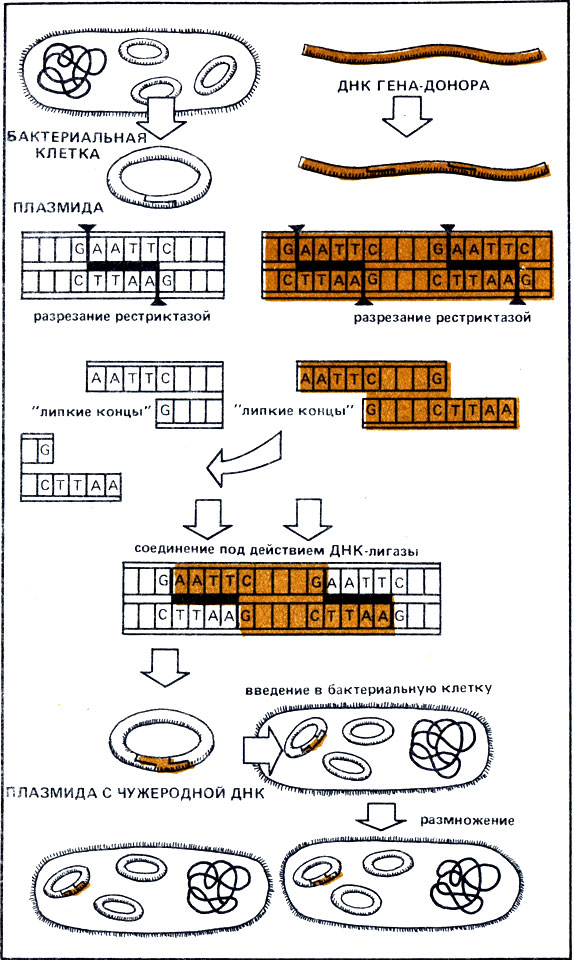
Рис. 35. Введение чужеродной наследственной информации в ДНК бактерий с помощью эндонуклеаз рестрикции и лигаз
Однако возникает проблема, как ввести эти искусственно созданные молекулы ДНК в клетку. Поскольку непосредственно этого сделать нельзя, то требуются "транспортные" средства. С. Коэн из Станфордского университета в Калифорнии первым использовал для этого плазмиды - маленькие кольцевые ДНК бактерий, которые находятся в клетке вне основной хромосомы и хромосомной ДНК. Плазмиды несут лишь небольшое число генов и могут проникнуть через мембрану бактериальной клетки. В июле 1973 г. таким образом удалось частично соединить дивергировавшие в течение сотен миллионов лет линии развития лягушек и бактерий. Коэн (совместно с Боуэром) с помощью рестриктаз разрезал ДНК лягушки, ввел ее при участии лигазы в бактериальную плазмиду, а последнюю в клетки кишечной бактерии E. coli. Хотя такие бактерии не квакали, тем не менее ДНК лягушки размножалась в них как своя собственная! Поскольку бактерии делятся очень быстро, то и введенная чужеродная ДНК может очень быстро удваиваться - процесс, получивший название клонирования. Путем клонирования любой фрагмент ДНК может быть размножен в бактериях в миллиарды раз, а потом с помощью рестриктаз снова выделен. Таким образом, ученые нашли возможность быстрого получения нужных фрагментов ДНК в больших количествах, а следовательно, и возможность массового получения определенных генов, которые в свою очередь, будучи встроенными в микроорганизмы, направляют синтез новых белков.
После этих опытов, имевших принципиальное значение для генной инженерии, началась кипучая деятельность ведущих монополистических групп, охватившая научные и коммерческие круги. Сначала преследовалась лишь единственная цель: вводя гены животных или человека в бактерии или дрожжи, заставить их синтезировать продукты, нужные для фармацевтической промышленности. В этом направлении были достигнуты определенные успехи. Гены инсулина из животных и человека были введены в бактерии, которые стали продуцировать соответственно животный или человеческий инсулин. Такими сконструированными бактериями был синтезирован гормон роста соматостатин, как и белок интерферон, подавляющий действие вирусов. В будущем по нашему желанию бактерии и дрожжи смогут производить в промышленных масштабах белковые гормоны, факторы свертывания крови, антитела и, что не менее важно, ферменты животного и растительного происхождения, а также человека. Возможно, что в один прекрасный день к генам будут относиться как к программам компьютеров и они будут использоваться в самых различных целях. Теоретически каждый существующий в природе белок может быть синтезирован "запрограммированными" соответствующим образом микроорганизмами. Можно пойти даже еще дальше и "проектировать" искусственные белки (например, ферменты с большей специфичностью, активностью и термостабильностью или ферменты, которые могут лучше использовать определенные источники сырья) на чертежной доске, а потом синтезировать их с помощью микроорганизмов. Возможность создания "по заказу" таких ферментов для определенных реакций сыграет решающую роль в широком применении ферментной технологии в промышленности.
Недавно в дополнение к описанным выше генно-инженерным методам появились методы "белковой инженерии", такие, как "сайт-специфический мутагенез". Методы белковой инженерии позволяют заменить в молекуле фермента единственную аминокислоту, короткие или более длинные пептиды, меняя таким образом свойства ферментов в нужном направлении. С помощью белковой инженерии удалось модифицировать субтилизин (протеазу, которая используется в моющих средствах), благодаря чему она становится более устойчивой к окислению пероксидом водорода H2O2, который образуется в перборатсодержащих моющих средствах и используется для отбеливания. Ученые из "Гененкора" (Сан-Франциско) заменили методами белковой инженерии остаток метионина (в положении 222 полипептидной цепи) на одну из 19 других обычных аминокислот, встречающихся в белках. "Нормальный" фермент после всего лишь двухминутного пребывания в очень концентрированном растворе H2O2 теряет 80% активности. Однако если метионин заменить на серии, аланин или лейцин, фермент, "пребывая" даже 16 мин в растворе пероксида водорода, теряет лишь 5% активности! Такой модифицированный фермент обладает удивительной стабильностью в растворе H2O2, и поэтому он незаменим в качестве компонента моющих средств. Вот вам первый практический успех белковой инженерии!
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'