
Принцип экономии клетки
Ключевые позиции в реакциях обмена веществ занимают ферменты - "регуляторы ритма", которые могут "включать" или "выключать" целые цепи ферментативных процессов. Эти регуляторные ферменты состоят обычно из двух или более идентичных субъединиц, тесно связанных между собой. Каждая субъединица имеет активный центр. "Сигналы" по управлению работой ферментов-регуляторов ритма исходят от контролируемых ими ферментативных цепей. Это определенные промежуточные или конечные продукты ферментативных реакций.
Как же могут эти продукты, которые часто совершенно не похожи на субстрат фермента-регулятора ритма, управлять функционированием регуляторного фермента? Эти вещества присоединяются к ферменту в одном или нескольких дополнительных местах связывания (сайтах), которые пространственно (стерически) отличаются от активного центра. Эти сайты называют аллостерическими центрами (от греч. иной, отличный), и они являются, так сказать, "щекотливыми местами" регуляторных ферментов, поскольку при связывании вещества в аллостерическом центре фермент изменяет свою пространственную структуру. Активный центр меняет свою форму, деформируется и становится функционально неактивным (в присутствии аллостерического ингибитора) или же стабилизируется (в присутствии активатора). При этом аллостерический ингибитор подавляет, а активатор активирует не только субъединицу фермента, с которой он соединен, но и по принципу "все или ничего" все остальные субъединицы фермента (рис. 17). Действие слабого сигнала тем самым существенно усиливается.
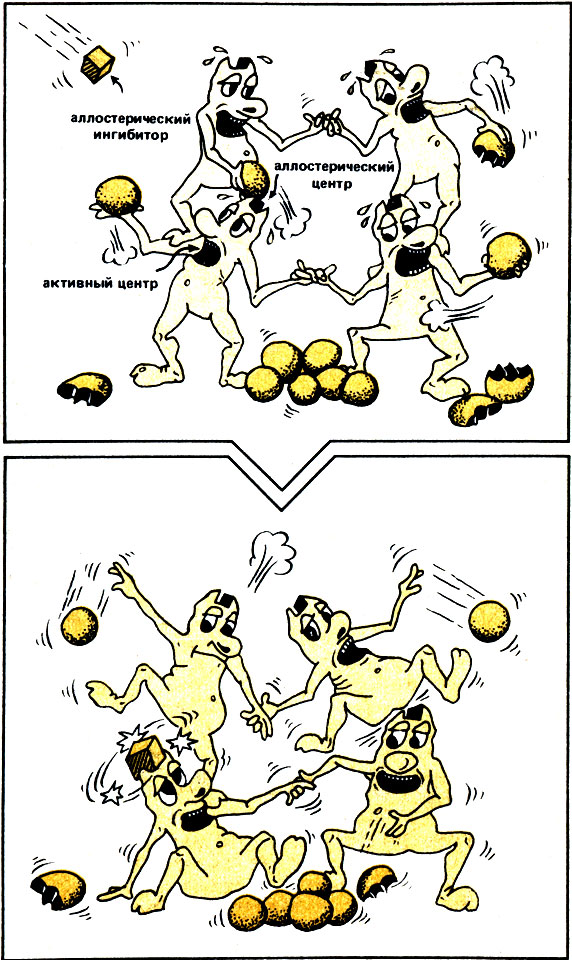
Рис. 17. Аллостерическая регуляция активности ферментов. Субъединицы фермента так тесно взаимосвязаны, что присоединение одной-единственной молекулы ингибитора в аллостерическом центре одной субъединицы приводит к изменению пространственной структуры всех остальных субъединиц, в результате чего они подавляются (принцип 'все или ничего')
Действующий в этом случае ферментативный принцип обратной связи позволяет, например, при "перепроизводстве" конечного продукта молниеносно отключить "ферментативный конвейер" до тех пор, пока не будет отщеплен или удален конечный продукт реакции (рис. 18). Таким образом, аллостерическая регуляция делает возможным взаимодействия между совершенно различными соединениями, а также способствует усилению слабых сигналов.
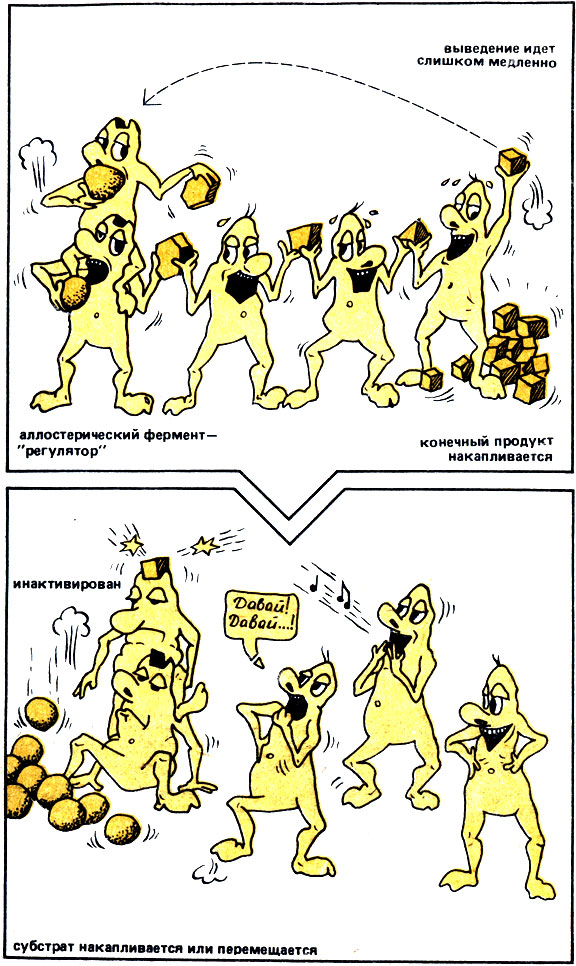
Рис. 18. Принцип саморегуляции в цепях ферментов (негативная обратная связь). При накоплении конечного продукта аллостерический фермент-'регулятор' в начале цепи ингибируется и таким образом 'выключается' вся цепь ферментов до тех пор, пока не будет ликвидировано 'перепроизводство'
При грубой регуляции также используется принцип аллостерии. Например, когда бактерии переносят с их "любимой еды" - глюкозы на другую питательную среду, содержащую только молочный сахар (лактозу), они резко прекращают свой рост. Бактерии не могут переварить лактозу. В их клетках просто нет достаточного количества ферментов. Но примерно через 20 мин покоя вновь начинается их стремительный рост. Очевидно, теперь бактерии располагают ферментами для расщепления лактозы. Это явление известно уже с 30-х годов под названием индукции. Тогда еще было высказано предположение, что вообще в клетке имеются два вида ферментов: важнейшие ферменты обмена веществ, которые входят в постоянный фонд клетки, в ее химическую структуру и непрерывно образуются примерно в одинаковых количествах (конститутивные ферменты), а также ферменты, которые образуются лишь при необходимости, причем этот процесс индуцируется определенными веществами. Эти индуцируемые ферменты служат для приспособления клетки к изменившимся условиям. Их концентрация в клетке очень сильно колеблется.
Следовательно, лактоза индуцирует синтез ферментов, регулирующих ее расщепление. Как показано на рис. 19, индукция лактозой протекает в присутствии бактерий. Непосредственно вблизи генов* ферментов расщепления находится участок ДНК (оператор), выполняющий роль "выключателя" генов. Этот "выключатель" блокируется аллостерическим "подавляющим" белком (белок-репрессор), который пространственно точно ему соответствует. Вследствие этого РНК-полимераза не может приступить к работе, гены ферментов, расщепляющих лактозу, "не считываются", не копируются в соответствующие мРНК и продолжают свой "сон", как спящая красавица. Ферменты расщепления не образуются.
* (Ген-это участок ДНК, в котором содержится информация для образования белка (или в конкретном случае фермента).)
И вот появляется "сказочный принц" - индуктор, в нашем случае лактоза*. Индуктор соединяется с активным аллостерическим белком-репрессором, изменяет тем самым его пространственную структуру и инактивирует его. Теперь пространственно он уже не подходит к оператору и поэтому отталкивается. Тем самым освобождается "выключатель"! Теперь уже РНК-полимераза может начать функционировать. Она копирует информацию, содержащуюся в генах, в длинную мРНК, которая выходит из клеточного ядра и направляется к рибосомам, где синтезируются ферменты расщепления лактозы. Новообразованные ферменты ускоряют теперь поглощение и переваривание лактозы. Вследствие этого все большее число молекул индуктора устремляется в клетку. За относительно короткий интервал времени в бактериальной клетке образовалось достаточно ферментов, чтобы она могла питаться одной лактозой. Если бактерии перенести вновь на питательную среду с глюкозой, индуктор мгновенно перестает действовать. Инактивированный индуктором белок-репрессор возвращается в свою активную форму, вновь связывается с оператором, останавливает работу РНК-полимеразы и синтез ферментов, расщепляющих лактозу.
* (Подлежащий расщеплению субстрат может быть также (но не обязательно) сам индуктором. В нашем случае "истинным" индуктором является собственно аллолактоза, которая образуется к началу индукции из лактозы с помощью имеющегося в клетке небольшого числа молекул лактазы.)
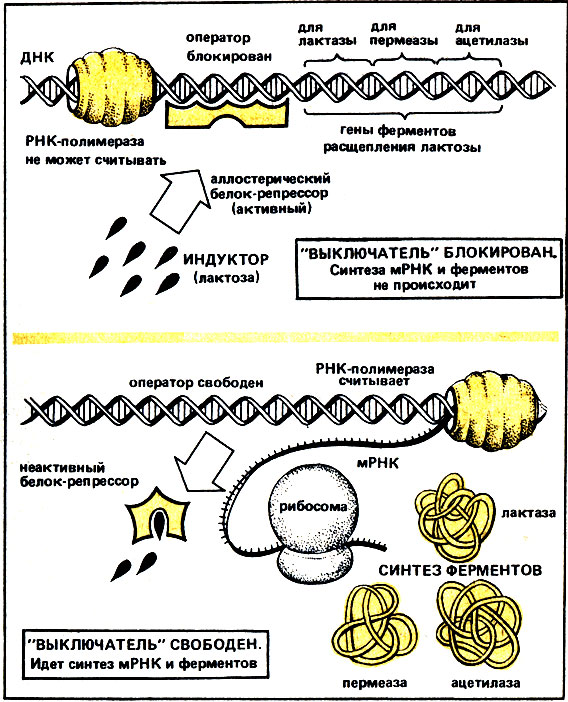
Рис. 19. Индукция под действием лактозы ферментов бактериальной клетки, расщепляющих лактозу
Подводя итоги, можно сказать, что при индукции ферментов индуктор всего лишь снимает ингибирование их синтеза. С помощью такого механизма грубой регуляции клетка может длительное время работать в режиме экономии. Действительно, это было бы в высшей степени неэкономично для любой бактериальной клетки при всем "непостоянстве нашей жизни" непрерывно синтезировать от шестидесяти до восьмидесяти различных ферментов для каждого возможного состава питательной среды. В этой главе мы не будем более подробно останавливаться на другом механизме грубой регуляции, сходном с вышеописанным, - репрессии, суть которой состоит в том, что подавляется "упрямое" продолжение синтеза ферментов, когда гигантские горы готового продукта лежат "перед дверьми" клетки.
У более высокоорганизованных живых существ индукция и репрессия регулируются более сложным путем, чем у бактерий. Эти процессы протекают медленнее и не так "драматично". Индукцию у высокоорганизованных живых существ могут вызывать не только питательные вещества, но и собственно гормоны, а также посторонние вещества. Наглядный пример-индукция ферментов печени человека с помощью лекарственных средств.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'