
Инструменты ферментов
"Квалифицированные" ферменты, которые функционируют вместе с коферментами, характеризуются, естественно, и более сложным механизмом действия, чем "простые" ферменты, такие, как лизоцим. Коферменты выполняют различные функции: они изменяют структуру субстрата, чтобы он легче мог вступать в реакцию с ферментом, переносят электроны, протоны и более крупные химические группы между ферментом и субстратом, часто на большие расстояния в пределах огромной молекулы фермента.
Такие коферменты, как НАД и НАДФ, относительно легко отделяются от фермента. Однако в активном центре фермента имеются еще другие небелковые группы, связанные прочными химическими связями. Их называют простетическими группами. К ним относится, например, гемогруппа - порфириновое кольцо, в центре которого находится атом железа. В ходе ферментативной реакции ферменты и простетические группы отдают электроны, протоны или целые химические группы, которыми они вновь "заряжаются" (регенерируют) по окончании реакции. Как и ферменты, простетические группы всегда многократно используются в клетке, в то время как субстраты обычно быстро расщепляются и выводятся. Поэтому с пищей должны постоянно поступать огромные количества субстратов (углеводов, белков, жиров). В то же время организму достаточно очень небольших количеств предшественников коферментов, витаминов. Однако, поскольку коферменты (как и ферменты) "изнашиваются" при постоянном их использовании, запас этих веществ должен все время пополняться путем синтеза из витаминов.
Что же играет решающую роль при превращении субстратов: белковые компоненты, апоферменты, коферменты или простетическая группа?
Чтобы ответить на этот вопрос, японский биохимик Ванг изучил каталазу-фермент, расщепляющий пероксид водорода H2O2. Каталаза в качестве простетической группы содержит геминовое железо; она относится к наиболее "быстродействующим" ферментам. Ванг проследил, как влияет железо в разных формах на расщепление H2O2. В отсутствие примесей пероксид водорода может сохраняться, не разлагаясь, месяцами. При добавлении же ионов железа наблюдалось его расщепление: 1 ион железа катализировал расщепление 1 молекулы H2O2 примерно за 30 мин. Ион железа действует как обычный химический катализатор. При добавлении к H2O2 гемогруппы (ион железа 4- порфириновое кольцо) за 1 минуту расщеплялись уже 5 молекул H2O2, т.е. процесс ускорялся в 150 раз. Таким образом, катализатор стал совершеннее. Когда же гемогруппа была соединена с соответствующим белком (апоферментом) с образованием каталазы, то такой "полный" фермент расщеплял 5 млн. молекул H2O2 за 1 мин! Следовательно, каталаза в 150 млн. раз эффективнее, чем ион железа. Трудно более наглядно продемонстрировать различие между биологическими и абиогенными катализаторами. Ионы железа и гемогруппы соответствовали здесь простым химическим моделям каталазы.
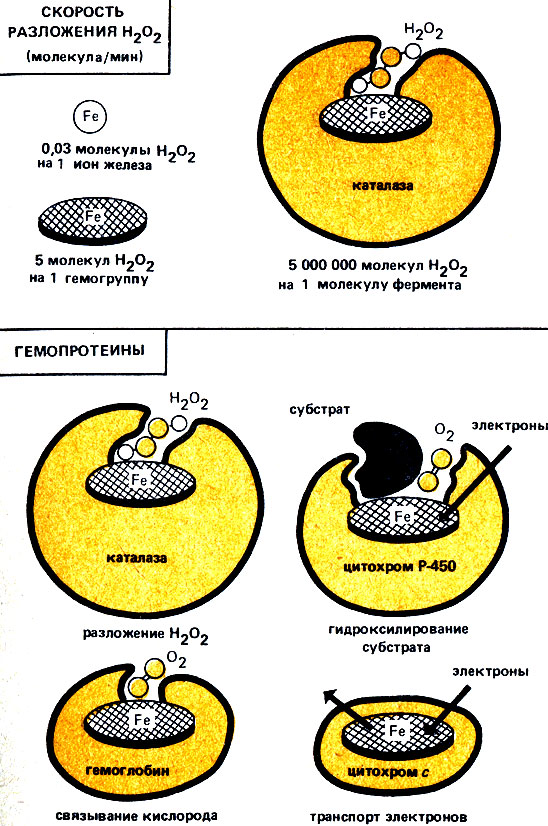
Рис. 6. Что определяет эффективность катализа и вид реакции: белковая или небелковая части фермента? Вверху - каталитическое разложение H2O2 под действием различных форм связанного и несвязанного железа. Внизу - гемопротеины (белки, содержащие в качестве простетической группы гем) и их реакционная способность
Итак, белковая часть фермента - это "мастер", от которого зависит эффективность работы фермента, а простетические группы и коферменты - его инструменты. Конечно, без инструментов даже самый лучший мастер беспомощен. Точно так же белок каталазы без гемогруппы полностью неактивен.
Что же, собственно, происходит, когда разные "мастера" используют один и тот же инструмент, т.е. различные белки взаимодействуют с одним и тем же коферментом или одной и той же простетической группой? Этот случай можно хорошо проиллюстрировать на примере белков, простетическими группами которых являются гемогруппы (гемопротеины). К ним относятся белки-переносчики кислорода (такие, как гемоглобин и миоглобин), переносчики электронов (например, цитохром с) и ферменты (такие, как каталаза, пероксидаза и цитохром Р-450). Все они имеют одинаковые простетические группы, но разные белковые компоненты. Как показано на рис. 6, они вступают в совершенно различные реакции с абсолютно разными соединениями.
На примере гемопротеинов легко уясняется, на что действует фермент и как он превращает субстрат-это в конечном счете определяется "мастером", т.е. белковыми компонентами фермента!
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'