
Как работает фермент?
О "всеядных" ферментах и ферментах-"специалистах"
Каждую секунду в клетке, имеющей диаметр менее 0,1 мм, протекают тысячи хорошо согласованных ферментативных реакций. Однако эта система функционирует только тогда, когда каждый из участвующих в ней ферментов среди тысяч различных веществ, имеющихся в клетке, точно "узнает" свой субстрат-то вещество, на которое он должен воздействовать.
Вот такой простой биохимический опыт может помочь понять этот процесс "узнавания" ферментом своего субстрата. Пусть в пробирке находится смесь углеводов: глюкоза (виноградный сахар), сахароза (свекловичный, или тростниковый, сахар), мальтоза (солодовый сахар), фруктоза (плодовый сахар) и крахмал. Добавим теперь к смеси фермент глюкозооксидазу и через некоторое время определим химический состав раствора. Глюкоза почти полностью исчезла! Вместо нее образовалось новое вещество глюконолактон - продукт окисления глюкозы. Все остальные углеводы остались без изменения. Очевидно, под действием глюкозооксидазы глюкоза превратилась в глюконолактон. Следовательно, глюкоза-это субстрат глюкозооксидазы, а глюконолактон - продукт ферментативной реакции. Из пяти различных углеводов только глюкоза была "избрана" в качестве субстрата глюкозооксидазой и превращена ею.
Уже в 1894 г. немецкий химик Э. Фишер (1852-1919) постулировал принцип "ключа и замка", считая, что ферменты методом проб и ошибок "узнают" свои субстраты. При этом некоторый участок на поверхности фермента, его активный центр, должен иметь такую форму, чтобы молекулы субстрата пространственно (геометрически и структурно) точно к нему подходили, как ключ к замку. Но даже незначительно измененные молекулы не вступают во взаимодействие с ферментом. Обратимся к рис. 1, где схематически изображены несколько молекул углеводов. Совершенно очевидно, что мальтоза, сахароза и, конечно, крахмал являются "слишком большими ключами". Фруктоза же, напротив, по размеру подошла бы к "замку" фермента, но вследствие несколько иного контура "ключа" - молекулы фруктозы-такой "замок" "не закрывался бы". Поэтому фермент на нее также не действует. Одна-единственная глюкоза по всем параметрам подходит к "замку". На рис. 1 показано, как глюкозооксидаза "узнает" свой субстрат, соединяется с глюкозой и во что превращает ее. Одновременно с глюкозой фермент связывает еще и кислород в качестве второго субстрата и восстанавливает его до пероксида водорода Н202. Оба субстрата образуют с ферментом фермент-субстратный комплекс, при этом они активируются и превращаются в продукты, которые затем отделяются от фермента.
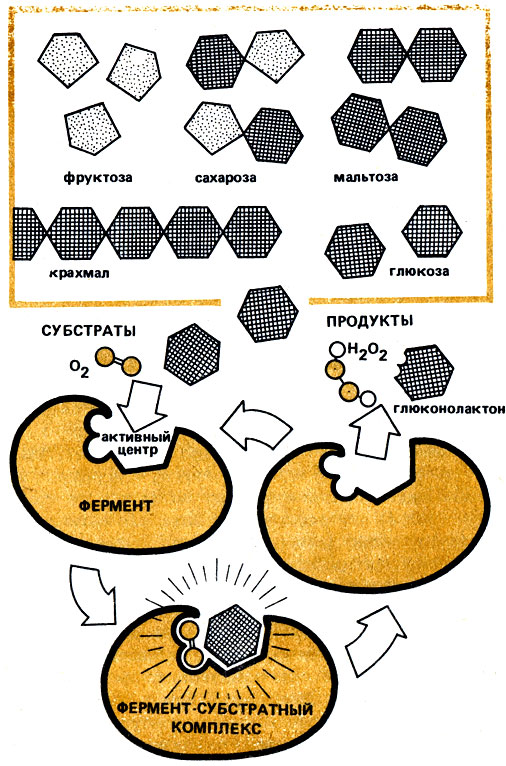
Рис. 1. Принцип 'ключа и замка': как фермент 'узнает' субстраты, связывается с ними и превращает их
Принцип "ключа и замка" прежде всего довольно хорошо объясняет высокую избирательную способность - субстратную специфичность ферментов. Понятно, что действие в клетке очень тонко скоординированных механизмов должно обусловливать высокую субстратную специфичность ферментов (это можно сравнить с устройством автоматического замка с секретом).
Однако в случае пищеварительных ферментов наблюдается скорее обратная картина. Они действуют вне клетки (внеклеточно) в желудке или кишечнике, и было бы неэкономно почти для каждого белка, попадающего с пищей в желудок, иметь особый, свой собственный фермент. Поэтому пищеварительные ферменты, такие, как пепсин, должны быть "всеядными", чтобы расщеплять все белки, попадающие в желудок. Таким образом, пепсин обладает низкой субстратной специфичностью, но высокой специфичностью действия. Он "разрезает" все белки в местах соединения совершенно определенных аминокислот. В отличие от химического производства, где нежелательные побочные реакции и побочные продукты представляют большую проблему, в биохимии при реакциях с участием ферментов катализируется только одна из многих принципиально возможных реакций, в результате чего образуются строго определенные продукты.
Эта специфичность действия ферментов послужила основой их единой классификации. В 1883 г. Дюкло, ученик Пастера, предложил образовывать название фермента, добавляя к названию субстрата суффикс "аза". Так, например, ферменты, расщепляющие сложные эфиры, получили название "эстеразы", расщепляющие целлюлозу - "целлюлазы", протеины - "протеазы". Поскольку, однако, многие вещества могут выступать как субстраты нескольких ферментов, вскоре было предложено включать в название ферментов еще и тип катализируемой ими реакции. Так, например, образованы названия глюкозооксидаза, глюкозоизомераза, глюкозодегидрогеназа. Наряду с этой классификацией продолжали использовать еще разнообразные тривиальные названия ферментов, такие, как дыхательный фермент, рН 5-фермент, старый желтый фермент. Это привело к возникновению множества недоразумений. Кроме того, число известных ферментов непрерывно увеличивалось. Так, в 1964 г. было уже описано девятьсот, в 1968 г. - тысяча триста, в 1975 г. - тысяча девятьсот ферментов, а в настоящее время число описанных ферментов существенно превышает 2000. Поэтому по предложению Международного биохимического союза (IUB)* все ферменты были разделены на шесть основных классов в соответствии со специфичностью их действия:
* (Номенклатура ферментов. Рекохмендации Международного биохимического союза по номенклатуре и классификации ферментов.- М.: ВИНИТИ, 1979.- Прим. перев.)
1. Оксидоредуктазы катализируют восстановительные и окислительные реакции (окислительно-восстановительные процессы).
2. Трансферазы осуществляют перенос той или иной химической группы от одного субстрата к другому.
3. Гидролазы катализируют гидролитическое расщепление химических связей субстратов.
4. Лиазы отщепляют химические группы с образованием двойных связей или, напротив, присоединяют определенные химические группы к двойным связям.
5. Изомеразы катализируют изменения в пределах молекулы субстрата.
6. Лигазы (синтетазы) катализируют соединение молекул субстрата с использованием высокоэнергетических соединений, например аденозинтрифосфата (АТФ)*.
* (АТФ (аденозинтрифосфат)- универсальный "накопитель" энергии, "энергетическая разменная монета" клетки. АТФ накапливает энергию, которая, например, выделяется при дыхании и может ее отдавать (в частности, для синтезов) путем отщепления фосфатных групп.)
Удивительно, что всё многообразие ферментативных реакций во всех живых существах можно сгруппировать всего лишь по шести принципам действия (рис. 2; на рисунке приведены названия конкретных ферментов, которые рассмотрены в этой книге).
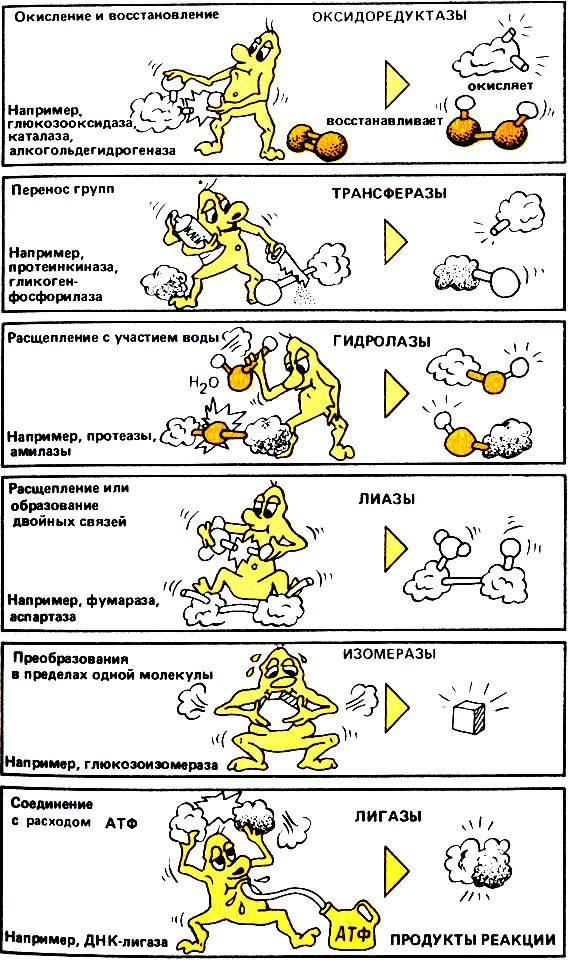
Рис. 2. Шесть основных классов ферментов, катализируемые ими реакции и некоторые типичные представители этих классов
В соответствии с классификацией Международного биохимического союза каждый фермент имеет кодовый номер (шифр), состоящий из четырех, разделенных точками чисел (класс, группа, подгруппа, порядковый номер фермента в подгруппе). Систематическое название фермента образуется из названия субстратов, участвующих в ферментативной реакции, и названия класса фермента, например для глюкозооксидазы следующим образом: β-D-глюкоза : кислород 1-оксидоредуктаза (кодовый номер 1.1.3.4.). Поскольку многие систематические названия ферментов довольно громоздки, в большинстве случаев по-прежнему используются тривиальные названия, такие, как глюкозооксидаза, пепсин и т.д. При этом в научной литературе необходимо дополнительно указывать кодовый номер фермента, а также его систематическое название.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'