
2. Водорастворимые витамины группы В
Грибы особенно нуждаются в водорастворимых витаминах группы В и главным образом в тиамине.
Тиамин (витамин В1, или анейрин). Отсутствие тиамина в пище вызывает у людей и животных заболевание полиневритом (бери-бери). В живых организмах он встречается в форме пирофосфата (рис. 5.1) и, кроме фосфорной кислоты, включает еще два компонента: 2-метил-4-амино-5-метилпиримидин (или просто пиримидин) и 4-метил-5β-оксиэтилтиазол (или тиазол). Предшественником первого компонента скорее всего является метилцитазин, являющийся одновременно предшественником тиамина.
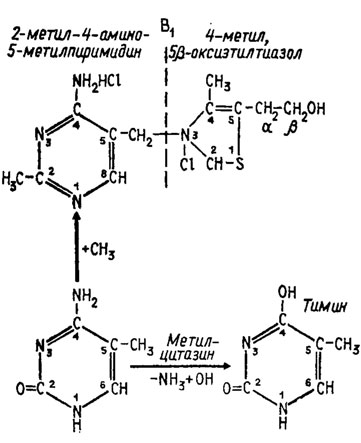
Рис. 5.1. Путь биосинтеза и структура витамина B1 (тиамина)
Потребность грибов в тиамине была впервые обнаружена одновременно Шопфером и Бургеффом в 1934 г. (Fries, 1965). Шопфер обнаружил, что урожай мицелия Phycomyces blakesleeanus на среде с концентрацией тиамина 1⋅10-9 возрастает в 350 раз, а зиготообразование у этого гриба увеличивается в 750 раз. Обладающий аналогичным эффектом тиаминпирофосфат известен как кофактор всех видов карбоксилаз, производящих декарбоксилирование органических кислот в процессах гликолиза и в цикле Кребса, а также транскетолаз, переносящих двууглеродные фрагменты Сахаров пентозного цикла, содержащих кетогруппы во втором положении.
Потребность в тиамине встречается у очень многих грибов из всех таксономических групп, включая оомицеты, сумчатые и базидиальные.
Большая часть грибов, нуждающихся в витамине В1, могут синтезировать его из двух компонентов - пиримидина и тиазола (табл. 5.2). Лишь немногие роды и виды, среди них все виды Phytophthora, Klockera brevis и Trichophyton discoides, нуждаются в полной молекуле тиамина (Fries, 1965).

Таблица 5.2. Грибы, нуждающиеся в целой молекуле тиамина и в отдельных ее компонентах
Третий вид гетеротрофии по тиамину состоит в потребности в пиримидиновой молекуле при наличии способности синтезировать ее тиазольную часть. Эта группа включает более десяти видов грибов. Наиболее малочисленны формы, неспособные синтезировать тиазол, среди которых в данное время насчитывается только четыре вида: Endotnyces magnusii, Mucor rammanianus, Stereum fructulosum и Trichophyton concentricum (табл. 5.2).
Избыток тиамина в среде иногда вызывает угнетение роста грибов, что связывают с его функцией как кофермента карбоксилазы и с накоплением при ее избытке в культуре грибов этилового спирта в результате декарбоксилирования пирувата. В дальнейшем, при использовании спирта грибом, развитие его достигало нормального уровня. Подобные явления, обнаруженные впервые Фостером и Голдманом у Rhizopus suinus, были далее обнаружены у Fusarium, у Ciborinia и у Saccharomyces carlsbergiensis. У Fusarium этот эффект можно нейтрализовать биотином, у Saccharomyces carlsbergiensis пиридоксином, у Rhizopus suinus - мезоинозитом (Фостер, 1950). Наоборот, при недостатке тиамина в культуре нуждающихся в нем грибов наблюдается избыточное накопление в ней пирувата, которое можно выявить с помощью реакции образования йодоформа. При добавлении в среду йода в смеси с йодидом калия и ее подщелочении при наличии в ней пировиноградной кислоты выделяется йодоформ, легко обнаруживаемый, по запаху.
Биосинтез тиамина у грибов протекает, видимо, по пути вторичного метилирования метилцитозина и последующей конденсации пиримидиновой части молекулы тиамина с тиазольной. У некоторых видов источниками тиазольной части молекулы тиамина могут служить пенициллин или бацитрацин (Ebringer, 1960). Наличие тиамина необходимо для спиртового брожения, но у обычных дрожжей эта потребность проявляется только при рН 5,0, но не при рН 3,5. Практически тиамин можно получать из очень-богатых им дрожжей; однако сейчас его чаще синтезируют химическим путем.
Рибофлавин, или витамин В2, составлен из изоаллоксазинового ядра и спирта рибитола - производного рибозы (рис. 5.2). Его функции в обмене веществ состоят в участии в качестве кофермента во всех флавиновых энзимах, а именно: 1) он является второй простетической группой ряда дегидрогеназ, а также оксидаз со строением гемов (Lindenmayer, 1965), где активной группой является флавинаденинмононуклеотид (ФМН), и 2) в форме флавинадениндинуклеотида он входит в состав глюкозооксидазы, т. е. принимает участие в первом этапе пути метаболизма гексоз через гексозомонофосфат (ГМФ), окисляя глюкозу и глюконовую кислоту. Кроме того, флавинадениндинуклеотид (ФАД) входит также и в состав сукцинатдегидрогеназы, окисляющей янтарную кислоту в фумаровую. Флавины входят также в систему нитрат-дегидрогеназ, лактатдегидрогеназ дрожжей и др. (Диксон, Уэбб, 1982).
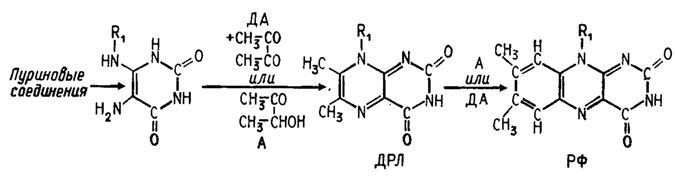
Рис. 5.2. Биосинтез рибофлавина у Eremothecium a'shbyii R1 - остаток рибитола; ДРЛ - 6,7-диметилрибуломазин; РФ - рибофлавин; ДА - диацетил; А - ацетонн
Из природных видов грибов, обладающих потребностью в рибофлавине, известна Porta vaillantii, нуждающаяся также еще в тиамине, биотине и аденине (Jennison et aL, 1955). Кроме нее существуют нуждающиеся в витамине В2 мутанты видов Aspergillus и Neurospora. При этом потребность мутанта Neurospora в этом витамине выявляется только при температурах выше 25°С. У некоторых форм, не требующих этого витамина для роста, он оказывается влияющим на их спорообразование. К таким видам относится Alternaria solani (Lukens, 1963). У Fusarium aqueductum он влияет на синтез каротиноидов (Rau, 1967).
Рибофлавин хорошо синтезируется многими грибами в больших количествах, вследствие чего они могут служить источниками для промышленного получения этого витамина, особенно представители семейства Spermophthoraceae и некоторые дрожжи. В качестве промышленных продуцентов рибофлавина фигурировали в основном три вида: Eremothecium ashbyii, Ashbyia (Nematospora) gossypii, Candida guillermondii, а также некоторые другие виды Candida. Для ферментации рибофлавина с помощью Eremothecium ashbyii используется среда, почти не содержащая углеводов (не более как от 0,25 до 1,5%), много животного белка или пептона (от 1 до 5%) и от 0,5 до 5% солодового экстракта как источника витаминов. При ферментации поддерживается температура от 27 до 30°С и производится искусственная аэрация. Начальное рН среды устанавливается на уровне 5,5. При этом на 1 мл культуральной жидкости образуется от 150 до 500 мкг В2. Особенно сильное влияние на биосинтез рибофлавина оказывают луриновые основания, пиримидиновое ядро которых, как это было локазано в исследованиях с хроматографией меченных изотопами промежуточных продуктов этого биосинтеза, полностью включается в изоаллоксазиновое ядро рибофлавина. Путь биосинтеза рибофлавина от рибитилпурина с расщепленным имидазольным кольцом через 6,7-диметилрибуломазин до рибофлавина указан на рис. 5.2. В обоих этапах синтеза оказались участвующими ацетоин или диацетил, постепенно надстраивающие на основе первоначального пиримидинового цикла два последующих кольца изоаллоксазинового ядра. При этом выяснилась необходимость постоянного присутствия в надстраиваемой молекуле спирта производного рибозы. В противном случае, при добавке в среду промежуточных продуктов реакции, биосинтез подавлялся.
Более широкое описание процесса биосинтеза флавиновых соединений и соотношения его с конкурентной системой биосинтеза веществ птеридиновой природы, входящих в пул фолиевой кислоты, даны в работе Ижевской (Jezewska, 1963 / рис. 5.3). По данной ею схеме, и те и другие соединения исходят из инозинрибозофосфата, но путь синтеза флавинов идет через ксантиловую кислоту, а трансформация ИМФ в гуаниловую кислоту приводит к образованию соединений типа фолиевой кислоты.
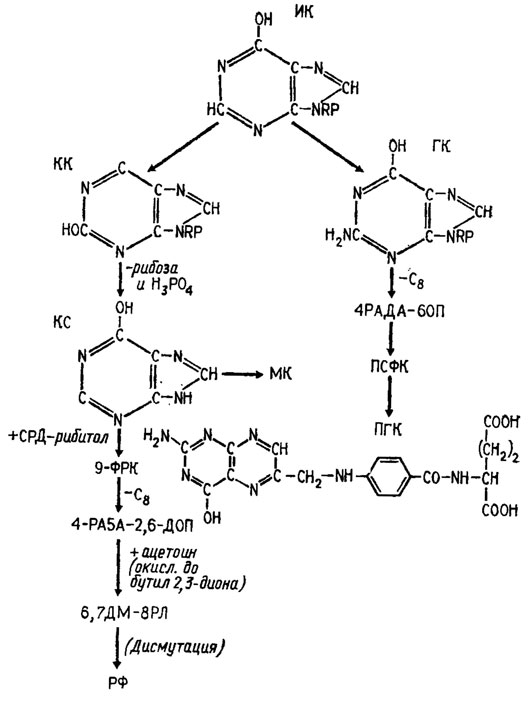
Рис. 5.3. Схема процесса биосинтеза птеридиновых и флавиновых соединений (Jezewska, 1963); ИК - ииозиновая кислота; КК - ксантиловая кислота; ГК - гуаниловая кислота; КС - ксантии; МК - мочевая кислота; 9-ФРК - 9-фосфорибитилксаитин; RP - рибозофосфат; 4-РА5А-2,6-ДОП - 4-рибитиламино-5-амино-2,6-диоксипиримидии; 6,7-ДМ-8РЛ - 6,7-диметил-8-рибитиллюмазии; РФ - рибофлавин; 4-РАДА-6ОП - 4-рибозиламино-2,5-диамиио-6-оксипиримидии; ПСФК - птеридиновая система фолиевой кислоты; ПГК - птероилглютаминовая (фолиевая) кислота
Кроме рибофлавина, накапливающегося главным образом в культуральной жидкости, Eremothecium ashbyii может синтезировать флавинадениндинуклеотид, являющийся, так же как и рибофлавин, важным для медицины витамином. В отличие от рибофлавина флавинадениндинуклеотид (ФАД) концентрируется преимущественно в мицелии продуцента (табл. 5.3 / Голышева, 1963), я выделяемый из него рибофлавин в основном приходится на содержащийся в ФАД (см. в таблице нижнюю строку, столбцы 4 и 6).
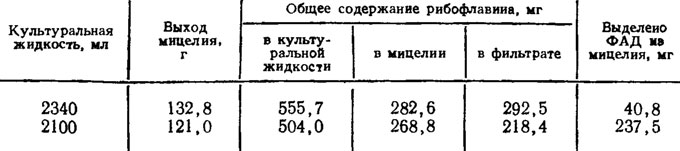
Таблица 5.3. Содержание ФАД и рибофлавина в мицелии и культуральной жидкости Eremothecium ashbyii (Голышева и др., 1963)
Кроме Eremothecium ashbyii для получения рибофлавина используют также близкую к нему форму Ashbyia gossypii. Для этого вида имеются данные, что у него при росте на синтетической среде образование рибофлавина стимулируется ацетатом аммония и синтетическими поверхностно-активными эфирами жирных кислот (Goodman, Ferrera, 1954).
Биотин, или витамин Н, представляет собой гетероциклическое соединение (рис. 5.4) с двумя сопряженными кольцами, включающими азот и серу, и боковой алифатической цепью. Он был выделен в форме самого витамина (у Torula utilis) или в форме его производных у целого ряда грибов - из Penicillium chrysogenum - дестиобиотин, из Aspergillus niger - биотин сульфоксид и у Saccharomyces cerevisiae, Memnoniella echinata, Stachybotrys atra и Candida albicans в форме оксибиотина. В составе пируваткарбоксил азы живых организмов биотин находится в форме, связанной с белком пептидной связью через Е-аминогруппу лизина (Ленинджер, 1974).
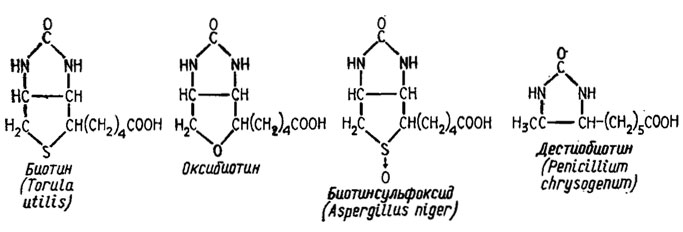
Рис. 5.4. Структура биотина и его аналогов, встречающихся у грибов
Хотя биотин и требуется в очень малых количествах, однако функции его довольно разнообразны. Известно, что он участвует в превращении орнитина в цитруллин, играет роль в усвоении аммиака и производит ряд реакций карбоксилирования, в частности превращение фосфоэнолпирувата в щавелевоуксусную кислоту и ацетата - в малоновую, при включении одной из них в цикл Кребса, а другой - в обмен жирных кислот. Известно, что щавелевоуксусная кислота при ее аминировании трансформируется в аспарагиновую. Поэтому Torula cremoris на среде с аспарагиновой кислотой значительно меньше нуждается в биотине, чем при росте на других средах. Биотин способствует использованию мочевины у Saccharomyces cerevisiae, входит в систему гексокиназы, участвует в дезаминировании некоторых аминокислот и в синтезе некоторых жирных кислот (Fries, 1965). Кроме Torula cremoris могут обходиться без биотина на среде с аспарагиновой кислотой Stachybotrys atra, Candida albicans и Ophiostoma pini (Perlman, 1965), причем у Candida albicans рост на среде без биотина возможен при введении в нее глицеринмоноолеата, а у Ophiostoma pini - олеиновой кислоты.
Эти особенности становятся понятными при учете роли биотина в образовании малоновой кислоты, являющейся исходным метаболитом при образовании ненасыщенных жирных кислот, в частности олеиновой. При недостатке биотина в культуре Pericularia oryzae накапливаются пировиноградная и α-кетоглутаровая кислоты и в особенности диметилпировиноградная кислота. Одновременно у нее тормозится накопление макроэргических фосфатов и кофакторов окислительно-восстановительных энзимов, важных для углеводного обмена (АТФ и НАД). Нуждается в биотине большой ряд грибов, особенно среди сумчатых и несовершенных, причем больше, чем у половины из них эта потребность комбинируется с потребностью в тиамине и в других факторах роста.
Для таких грибов, как Saccharomyces cerevisiae, Memnoniella echinata, Stachybotrys atra и Candida albicans, биотин может быть заменен оксибиотином, хотя активность последнего составляет только 10-20% от активности биотина. Отличие его от биотина состоит в замене серы в кольце кислородом. Дестиобиотин, вероятно, является промежуточным продуктом при синтезе биотина. Он был обнаружен у Penicillium chrysogenum (Miller, 1961) и может удовлетворять потребность в биотине у мутантов Neurospora crassa. На Ophiostoma pint он действует как ингибитор обмена. Другое производное биотина, образующееся наряду с ним у Aspergillus niger, - биотинсульфоксид, обладает для некоторых грибов той же активностью, что и биотин (см. рис. 5.4). Кроме оксибиотина, дестиобиотина и биотинсульфоксида имеются и другие близкие к биотину и активные в отношении некоторых грибов производные. Например, биоцитин стимулирует рост Isaria cretacea (Tabor, Vining, 1959) и Saccharomyces carlsbergiensis. Ряд других соединений биотина нередко оказываются не стимуляторами, а конкурентными ингибиторами роста для отдельных видов грибов (Fries, 1965).
Биотин оказалось возможным получать с выходом от 0,5 до 3,6 мкг/мл у Torula utilis (Miller, 1961), но такие выходы не позволяют ставить вопрос о промышленном производстве биотина из этого источника.
Никотиновая кислота, или витамин РР (ниацин), недостаточность которой вызывает у людей заболевание пеллагрой, представляет собой производное пиридина с замещенным карбоксильной группой водородом по атому С3:
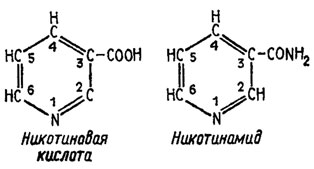
В физиологических функциях участвует не она сама, а ее амид, и эти функции очень широки, поскольку в сочетании с аденином никотинамид участвует практически во всех реакциях дегидрогенизации и гидрогенизации, т. е. окисления и восстановления через отнятие или присоединение водорода. Кроме никотинамида и аденина коферменты дегидрогеназ содержат две молекулы рибозы и две (в НАД) или три (в НАДФ) молекулы фосфорной кислоты. Восстановительные реакции осуществляются восстановленными формами этих коферментов (НАДН или НАДФН), которые одновременно могут, подобно АТФ, служить запасниками энергии. Металлическим компонентом таких дегидрогеназ чаще всего оказывается цинк. В числе дегидрогеназ, включающих цинк, находятся алкогольдегидрогеназа, малатдегидрогеназа, аконитаза и ряд других, НАД-дегидрогеназы участвуют в подавляющем числе случаев в начальной ступени переноса электронов в дыхательной цепи, являясь первым акцептором водорода от окисляемого субстрата. Никотинамид участвует также в системе ферментов, восстанавливающих нитраты при образовании макроэргических фосфатов в процессе окислительного фосфорилирования.
Потребность в никотиновой кислоте среди грибов больше всего выражена у сумчатых, в особенности у дрожжей, а также у некоторых дерматофитов. Среди хитридиомицетов выявлены три вида с потребностью в витамине РР - два из рода Blastocladia и один из рода Phlyctorhiza. Из базидиомицетов нуждается в никотиновой кислоте Pholiota aurea, но и на среде без никотиновой кислоты она также может расти при введении в нее тиамина и даже лучше, чем при добавке одного витамина PP.
Кроме этого вида имеет потребность в витамине РР один мутант, полученный у Polyporus abietinus (Fries, 1965). Такие мутанты способны довольствоваться вместо никотиновой кислоты триптофаном, однако среди природных видов это наблюдалось только у одного дерматофита Trichophyton equinum. Из других пиримидиновых соединений обладающим стимулирующим действием в отношении роста Fusarium solani оказался сам пиридин, добавленный в концентрации 0,5⋅10-3 моля.
Пантотеновая кислота, или витамин В3, была изолирована из Saccharomyces cerevisiae как фактор роста дрожжей, но одновременно оказалась витамином, необходимым животным. Она представляет собой следующий комплекс:
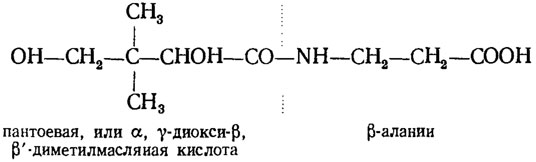
Основной функцией пантотеновой кислоты в организмах является участие ее как предшественника в биосинтезе коэнзима А, функции которого очень многообразны, но в основном состоят в переносе двууглеродных фрагментов, преимущественно остатков ацетата, и конденсации их между собой или с каким-либо ранее образовавшимся соединением с четным числом атомов углерода. В результате этого процесса образуются новые алифатические соединения с увеличенной на два углеродных фрагмента цепью. В настоящее время известны такие включающие пантотеновую кислоту и занимающие важное место в узловых пунктах метаболизма соединения, как ацетилКоА, малонилКоА, сукцинилКоА, бутирилКоА, капронилКоА и другие. Вследствие способности участвовать в реакции конденсации КоА играет решающую роль в биосинтезе кислот цикла Кребса (лимонной, янтарной и яблочной), жирных кислот и в первых этапах обмена терпенов (синтез мевалониевой кислоты).
Последним этапом биосинтеза пантотеновой кислоты в клетке, видимо, является конденсация через пептидную связь пантоевой кислоты с β-аланином. Поэтому некоторые способные самостоятельно синтезировать пантоевую кислоту дрожжи, например Schizosaccharomyces pombe, удовлетворяются вместо полной молекулы витамина В3 одним β-аланином. Аналогично ведет себя штамм Мейера Saccharomyces cerevisia. Обратное явление наблюдается у гименомицета Polyporus texanus, который оказывается способным синтезировать β-аланин, но нуждается в пантоевой кислоте.
Обладающих потребностью в пантотеновой кислоте видов грибов сравнительно немного. К ним относятся главным образом дрожжи из родов Saccharomyces, Schizosaccharomyces, Zygosaccharomyces и Candida. Из числа базидиомицетов нуждается в ней Polyporus texanus, а из семейства Aspergillaceae - Penicillium digitatum, которому наряду с этим витамином необходим также ряд других (Fries, 1965).
Пиридоксин, или витамин В6 (адермин), был изолирован как витамин животных, влияющий на рост крыс. Одновременно было установлено, что он обладает стимулирующим эффектом в отношении роста микроорганизмов. Как и никотиновая кислота, пиридоксин является производным пиридина и существует в организмах в трех формах - пиридоксина (двухатомного спирта), пиридоксаля (с заменой одной спиртовой группы на альдегидную) и пиридоксамина (с замещенной аминной гидроксильной группой):
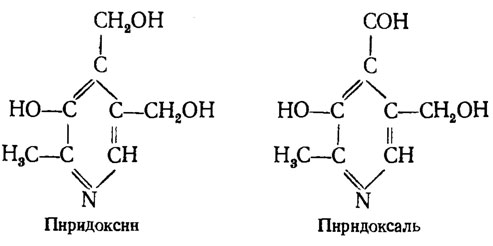
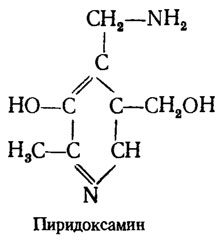
В большинстве ферментов он представлен в форме пиридоксальфосфата. Основная функция пиридоксина состоит в его участии в обмене аминокислот. Так, он принимает участие в последнем этапе восстановления нитратов при включении аммиака в α-кетокислоты, в реакциях переаминирования в трансформации триптофана в индол и участвует в биосинтезе аланина, а также, видимо, биогенных аминов грибов. Потребностью в пиридоксине обладают главным образом дрожжи и некоторые сумчатые грибы, такие как виды Ophiostoma, Ascoidea rubescens, а также Trichophyton discoides из числа дерматофитов. Потребность в пиридоксине, как правило, комбинируется с потребностью в других факторах роста. Из различных производных пиридоксина Saccharomyces carlsbergiensis и Ophiostoma multiannulatum лучше растет на пиридоксамине, а некоторые мутанты О. multiannulatum испытывают в нем специальную потребность.
Мезоинозит (i-инозит, миоинозит или гексаоксоциклогексан). Стимулирующий эффект мезоинозита в отношении роста дрожжей был установлен еще в 1928 г. в опытах, проведенных на Saccharomyces cerevisiae (Eatscott, 1928). Структура его очень сходна со структурой гексоз и образуется он, видимо, в цикле пентоз.
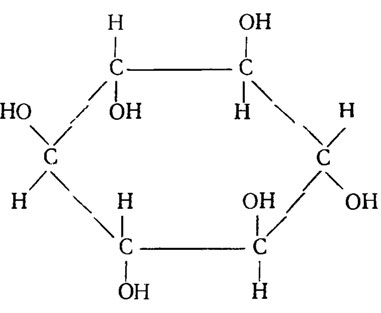
Однако физиологическая роль его в обмене пока еще не вполне ясна. Очевидно он играет роль в окислительных процессах, локализованных в митохондриях. Фосфорилированный мезоинозит был обнаружен в составе митохондрий (Lindenmayer, 1965). О необходимости его для сохранения структуры митохондрий удалось сделать вывод на основе исследований над нуждающимися в мезоинозите видами дрожжей - Saccharomyces carlsbergiensis и Klоckere apiculata. Потребность в мезоинозите характерна для многих дрожжей и других сумчатых грибов. Чаще всего эта потребность ассоциируется с одновременной потребностью в тиамине или биотине. Обычно мезоинозита требуется заметно больше, чем других витаминов, а именно порядка 1 мкг/мл и более, что объясняется, видимо, его участием в структурных образованиях в конструкции митохондрий.
Парааминобензойная кислота представляет собой часть фолиевой, или птероилглютаминовой, кислоты - комплексного соединения, составленного из близкого по строению к пуринам птеридина, парааминобензойной и глютаминовой кислот, из которых две последние соединены между собой пептидной связью:
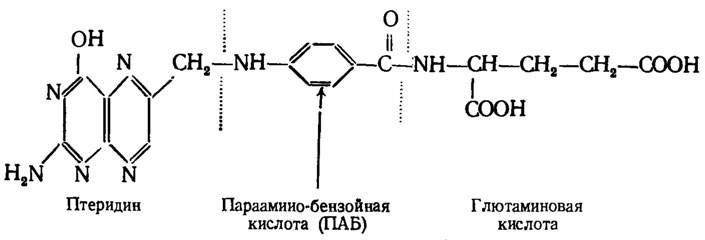
Потребности грибов в парааминобензойной и фолиевой кислотах нередко совпадают, так как потребность в ПАБ означает недостаточную способность к синтезу одного из компонентов фолиевой кислоты. Фолиевую кислоту обычно характеризуют как "пул фолиевой кислоты", поскольку это не одно химическое соединение, а целая группа родственных веществ: птероилглютаминовая, птероилтриглютаминовая, птероилгептаглютаминовая и другие подобные кислоты. В организмах встречаются так же как представители этого пула ризоптерин, лейковорин и биоптерин.
Основная функция, которую несет фолиевая кислота, заключается в ее участии в синтезе пуринов, в трансметилировании и в синтезе ряда аминокислот. Пул фолиевой кислоты является основным источником одноуглеродных фрагментов в таких синтезах, как формиат или метильная группа (СН3).
Грибы обычно хорошо синтезируют фолиевую кислоту, в особенности если для этого синтеза имеется готовая парааминобензойная кислота, но и в ПАБ они нуждаются редко. Потребность в ПАБ была установлена у Rhodotorula, которая реагирует уже на концентрацию этого витамина в 0,03 мкг/мл, и, хотя и способна использовать вместо него фолиевую кислоту, однако в отсутствие ПАБ нуждается в ее количестве, в 10-50 раз превышающем необходимое ей количество ПАБ (Fries, 1965). В ПАБ нуждается также несколько штаммов Saccharomyces cerevisiae, Blastocladia pringsheimii, Cortinellus berkelianus и несколько искусственно полученных мутантов Neurospora.
Биосинтезы ПАБ и никотиновой кислоты у грибов были изучены с помощью мутантов Neurospora и оказались связанными общими предшественниками с синтезом антриниловой кислоты, индола, триптофана и ароматических аминокислот (тирозина и фенилаланина) (рис. 5.5). Сходно идет, видимо, биосинтез этих веществ у дрожжей. Так, например, полученный при действии мутагенов штамм Hansenula anomala может накапливать большие количества триптофана, очевидно, в силу торможения его использования далее на синтез никотиновой кислоты (Рубан, Лобырева, 1967). На синтез витаминов из группы В у дрожжей сильно влияют источники углерода. При изучении биосинтеза этих витаминов у видов рода Candida, адаптированных к росту на ацетате (С. utilis), парафине (С. lipolytica) и феноле (Candida sp. Ф-201), оказалось, что эти дрожжи образуют большее количество некоторых витаминов на тех субстратах, к которым они адаптированы, чем на глюкозе, С. lipolytica образует на парафине больше тиамина и инозита, С. utilis на ацетате - тиамина и никотиновой кислоты и Candida sp. Ф-201 на феноле - больше тиамина, инозита, биотина и пиридоксина (Борукаева, 1967).
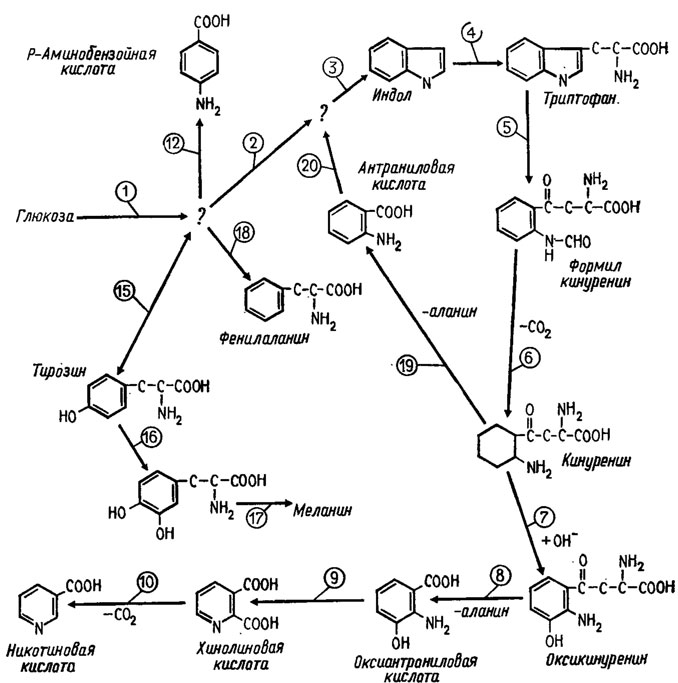
Рис. 5.5. Пути биосинтеза никотиновой и парааминобензойной кислот, построенные на основе исследований над дефицитными по этому обмену мутантами Neurospora crassa
Витамин В12 (цианкобаламин) состоит из 5-дезоксиаденозина в сочетании с циклической корриновой системой и бензимидазолрибонуклеотидом (рис. 5.6) (Ленинджер, 1974). Металлическим компонентом этого витамина является кобальт. Вопрос о значении витамина B12 для грибов в микологической литературе до недавнего времени вообще не ставился. Считалось, что у грибов он либо отсутствует, либо имеет малое значение, поскольку у изучавшихся видов не удавалось выявить влияния на их рост входящего в состав этого витамина кобальта или самого витамина В12. Сейчас установлено, что грибы образуют вещества с активностью витамина B12 и, следовательно, они играют роль в их обмене. Однако четкая зависимость роста от витамина B12 была найдена только у одного вида гриба, встречающегося в природе, у морского вида из Labyrintulales Thraustochytrium globosum (Adair, Vishniac, 1958). Четыре других фактора из группы витамина В12 были в отношении этого вида неактивны. Активная концентрация витамина В12 для этого гриба оказалась очень низкой и не превышала 5 мкг/л. Частичная дефицитность в отношении синтеза витамина B12 была также обнаружена у Candida albicans (Littman, Miwatani, 1963), и в этом случае активная концентрация его приближалась к 1 мкг/мл и выше. Чувствительны к нему также и некоторые дрожжи, например Klockera brevis, с помощью которой его определяют.
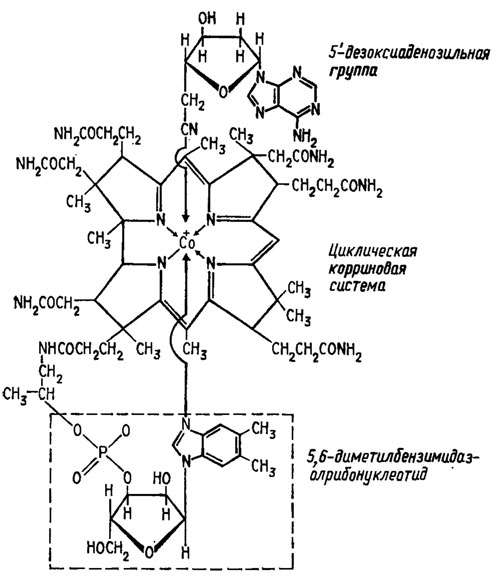
Рис. 5.6. Строение витамина B12 (циаикобаламина/Ленинджер, 1974)
Из числа других соединений со сходной структурой была обнаружена потребность в гемине для роста Pilobolus. Эффективными в отношении этого рода грибов оказались несколько производных гемина, например копроген и феррихром. Требующиеся для этих o грибов количества порфириновых соединений несколько выше, чем необходимые обычно представителям царства грибов количества витаминов, и достигают нескольких миллиграммов на литр среды.
Витамин С (аскорбиновая кислота).
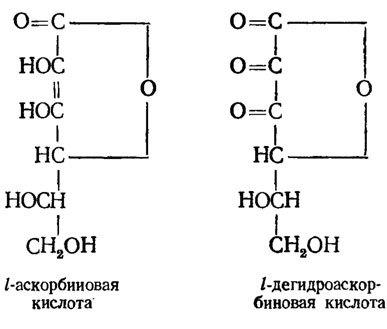
Витамин С имеет структуру, сходную с кетосахарами, и функции его связаны с его способностью легко окисляться в дегидроаскорбиновую кислоту. Потребность в аскорбиновой кислоте у грибов неизвестна. Видимо, они очень хорошо синтезируют ее по ксилулозному пути углеводного обмена через промежуточные стадии глюкуроновой и гулоновой кислот. Ее можно легко обнаружить в мицелии грибов обычно используемым в гистохимии способом - реакцией с азотнокислым серебром. Такая реакция хорошо удавалась при обработке этим способом мицелия Penicillium chrysogenum из погруженной культуры для получения пенициллина (Беккер, 1956, 1963) или распространяющегося в ткани растения хлопчатника мицелия возбудителя фузариозного вилта Fusarium oxysporum (Пушкарева, Беккер, 1973).
Ростовые вещества высших растений (β-индолилуксусная кислота, или гетероауксин) различно воздействуют на рост грибов. Причем этот эффект может выражаться как в стимуляции, так и в угнетении развития грибов. Стимулирующий эффект ИУК был обнаружен у Sclerotinia fructigena, для которой она может заменять фактор освещения, необходимый ей для споруляции (Khan, 1966). При культивировании ее в темноте, где конидии обычно не образуются, добавка 50 мг/л ИУК оказывается достаточной, чтобы вызвать споруляцию этого гриба. Однако при добавлении ИУК в среду освещаемой культуры интенсивность образования конидий уменьшается. Таким образом, синергизма в действии этих двух факторов не обнаружено, что говорит о различном механизме действия света и ИУК на споруляцию. Для некоторых грибов, например Nectria galligena и Neurospora tetrasperma, ИУК является угнетающим рост фактором, действие которого на них нейтрализуется защитными веществами со свойствами термостабильности. Nectria galligena менее способна образовывать эти защитные вещества и поэтому ингибируется более низкими концентрациями, β-индолилуксусной кислоты, чем Neurospora tetrasperma.
Многие паразитные грибы, особенно те из них, которые вызывают аномальные разрастания тканей у поражаемых ими растений, не только не страдают от избытка ИУК, но, видимо, и сами продуцируют ее в больших количествах. Сюда относятся головневые грибы, Taphrina и целый ряд других. На среде с аминокислотами Taphrina образует много веществ со свойствами ауксинов. В присутствии фенилаланина, гистидина и триптофана она образует ИУК, в присутствии остальных аминокислот - другие ауксины. ИУК выделяется у нее также на среде с индолом и серином, хотя внесение в нее смеси моноаминокислот и подавляет этот синтез. Промежуточным продуктом синтеза ИУК, очевидно, является триптофан, также обнаруживающийся в культуральной среде Taphrina. Образования индола из антраниловой кислоты, которое наблюдалось у дрожжей, у этого организма не обнаружено.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'