
Свертывание крови: пустяковая причина и серьезные последствия
При порезе пальца кровь течет сначала с постоянной скоростью и быстро, однако вскоре ток крови замедляется. Она становится густой, "запекается", при этом выделяется прозрачная жидкость (сыворотка). Процесс заканчивается через несколько минут. Рана закрыта. "Герметизация" раны достигается благодаря образованию плотной сетки из молекул фибрина. Сгусток фибрина возникает из фибриногена с помощью каскадного механизма, включающего различные факторы свертывания крови. Большей частью они представляют собой образованные в печени протеазы. Факторы находятся в крови в виде предшественников - неактивных проферментов. На рис. 26 в упрощенной форме представлен каскадный механизм активации. Смысл его (как и в случае каскадного расщепления гликогена) состоит в усилении в миллионы раз слабого сигнала - в данном случае сигнала о повреждении сосудов - и в мощной реакции организма на это. Сигнал пока еще неизвестным образом активирует фактор свертывания крови XII, очевидно путем контакта на поверхности со структурным белком коллагеном, высвобождаемым при ранении. После этого включается постоянно нарастающий каскадный механизм свертывания крови. В заключение фибриноген превращается в молекулу фибрина активированным ферментом тромбином. Молекулы фибрина соединяются в цепи, которые переплетаются между собой, образуя прочную сеть под действием следующего фактора свертывания. В результате возникает нерастворимый фибриновый "ковер", который сокращается и стягивает края раны, отжимая при этом прозрачную жидкость-сыворотку.
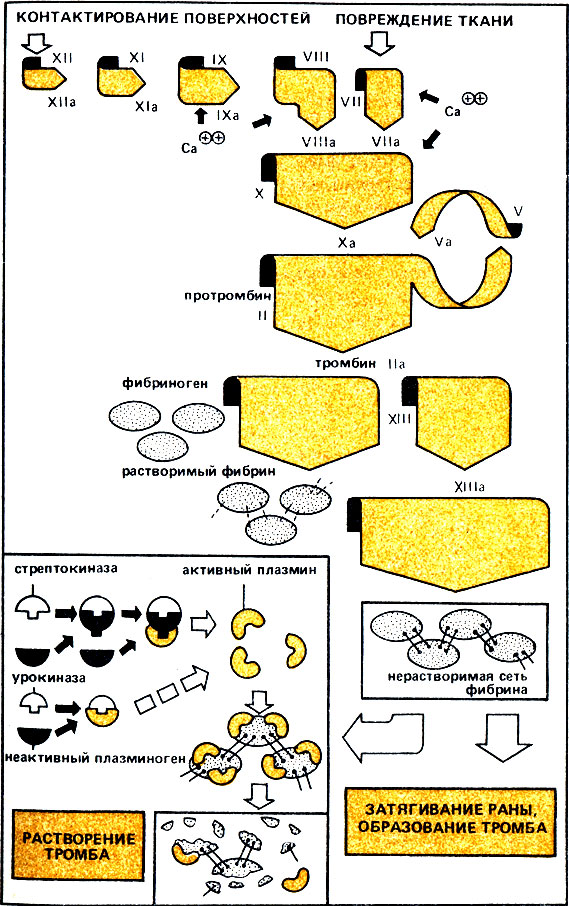
Рис. 26. Вверху - упрощенная схема каскадного механизма свертывания крови; внизу - растворение тромбов под действием урокиназы и стрептокиназы
Высокая активация при каскадном механизме, достигающая усиления примерно в 1 млн. раз, таит в себе большую опасность. Начавшись, этот процесс может привести к тому, что кровь будет свертываться не только в месте ранения. Она полностью свернется во всем организме. Поэтому активность факторов свертывания в значительной мере контролируется рядом ингибиторов, которые могут "вмешаться" на любой стадии активации и ограничить свертывание крови во времени и пространстве. При полном отсутствии факторов свертывания (например, фактора VIII при гемофилии) или при их недостаточности вследствие заболеваний печени могут возникнуть нарушения процесса свертывания крови.
Гемофилия-это одно из наиболее изученных наследственных заболеваний. Самой знаменитой носительницей дефектного гена, обусловливающего это заболевание, была английская королева Виктория. От нее этот ген передался королевским фамилиям России, Испании и Пруссии. Для страдающих гемофилией даже самые незначительные порезы и ушибы могут оказаться смертельными. В мире зарегистрировано 45000 больных гемофилией. Сейчас это заболевание лечат с помощью факторов VIII и IX, которые получают из донорской крови. Многие компании, занимающиеся биотехнологией, пытаются получить эти факторы методами генной инженерии, используя микроорганизмы.
Наряду со свертыванием крови жизненно важной проблемой является растворение сгустков фибрина (тромбов). Тромбы могут образоваться в кровеносных сосудах и в самом сердце в результате свертывания крови. При этом может произойти полная или частичная закупорка сосудов и возникнуть опасные для жизни осложнения. Протеаза плазмин ответственна в организме за растворение сгустков крови. Ее неактивный предшественник плазминоген входит в их состав. Предполагают, что различные специфические тканевые активаторы катализируют активацию плазминогена. Возникающий при этом плазмин разрывает фибриновую сеть, "дробит" молекулы на маленькие частички, растворимые в крови. Так разрушается и тромб. При лечении тромбозов и инфаркта миокарда раньше больным вводили плазмин. Однако более эффективным оказалось использование активаторов плазминогена. Самым известным из них в организме человека является урокиназа. Ее получают из мочи человека, поэтому она является идеальным активатором, не имеющим серьезных побочных иммунологических действий. Урокиназа непосредственно превращает плазминоген в плазмин. Однако ее производство связано с большими расходами и затратами труда, так как из 200 л мочи можно получить лишь около 2 мг высокоочищенной урокиназы. Поэтому пока работают со стрептокиназой, выделяемой из стрептококков. Она образует с плазминогеном комплекс, превращающий другие молекулы плазминогена в активный плазмин. Стрептокиназа дает также хорошие результаты при растворении старых тромбов. Однако повторное применение бактериальной стрептокиназы может вызвать неблагоприятные иммунологические реакции. Поэтому сейчас усилия ученых направлены на то, чтобы с помощью методов генной инженерии в бактериях получать дешевую человеческую урокиназу в больших количествах (см. ниже).
Человеческая урокиназа, полученная с помощью бактерий, уже проходит клинические испытания. Однако даже у этого фермента есть один серьезный недостаток: он уменьшает свертываемость крови во всем организме, то есть большие количества урокиназы могут вызвать опасные для жизни внутренние кровоизлияния.
Тканевые активаторы плазминогена позволяют успешно преодолеть эту проблему. В отличие от стрептокиназы и урокиназы они прежде всего связываются с фибрином тромба и таким образом как бы "метят цель" для неактивного плазминогена. Поэтому лишь в непосредственной близости от фибриновой "затычки", а не во всей сосудистой системе происходит активация плазминогена. Образующийся активный плазмин растворяет лишь тромб, не влияя на общую свертывающую способность крови. Сейчас человеческий тканевый активатор плазминогена, полученный с помощью генной инженерии, проходит клиническую проверку. Его использование в медицине послужит поворотным моментом в борьбе против "убийцы номер один" - инфаркта миокарда.
Другой фермент позволяет бороться с нарушениями в тканях, лишенных тока крови, при сердечной ишемии и трансплантации почек. Перфузия для восстановления притока кислорода может привести к образованию очень реакционноспособных пероксидных радикалов, которые служат пусковым механизмом для многих опасных для человека окислительных процессов. С помощью супероксиддисмутазы (СОД) можно эффективно предотвратить их. Для этого при перфузии используют СОД вместе с тромболитическими ферментами. СОД в граммовых количествах уже удалось синтезировать в клетках Escherichia coli. Такой фермент проходит клинические испытания. Кроме того, СОД, вероятно, обладает также защитным действием против радиации и воспалительных процессов. По оценкам, от реализации СОД ожидаются большие доходы, сравнимые с теми, которые получены от продажи тромболитических ферментов (~ 500 млн. долларов в год).
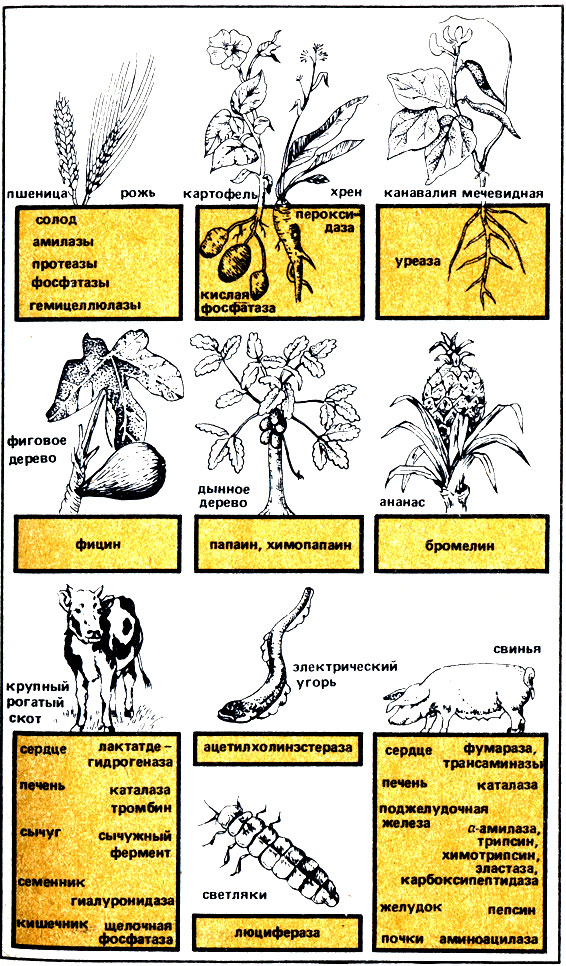
Рис. 27. Источники ферментов растительного и животного происхождения
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'