
Четырнадцать минус восемь равно четырнадцати
Любители математических головоломок ничуть не удивились бы, взглянув на арифметическое выражение 14 - 8 = 14: они видали задачи и потруднее. Например, УДАР + УДАР = ДРАКА или 11 + 10 = 101; в первом из приведенных равенств надо заменить одинаковые буквы на одинаковые цифры (У = 8, Д = 1, А = 2, Р = 6, К = 5), а во втором - сообразить, что числа записаны не в десятеричной, а в двоичной системе. В таких примерах главное - соблюдение всех правил формальной логики, но как раз в этом смысле равенство, вынесенное в заголовок, составляет исключение: в мире десятичных чисел шесть не равно четырнадцати, а в мире пептидных биорегуляторов такое случается, о чем и повествует следующая история.
Без особого опасения ошибиться можно предположить, что у многих читателей нашей книги есть дети, еще не достигшие восемнадцати-девятнадцати лет, а, может быть, кое-кто из самих читателей, к собственному удовольствию, не дорос до этого возрастного рубежа. Слова "не дорос" следует здесь понимать буквально, хотя отдельные органы у человека обладают способностью расти в течение всей жизни (например, нос), свои основные "габариты" человеческий организм приобретает к восемнадцати-двадцати годам. А в условиях развившейся на наших глазах акселерации, ускорения роста - даже к шестнадцати-семнадцати.

'Не дорос'
Но бывает, к сожалению, и так, что шестнадцатилетний ребенок имеет комплекцию десятилетнего и на фоне своих сверстников-акселератов выглядит карликом. Взволнованные родители утешают себя тем, что дети вообще развиваются неравномерно, что ребенок отдаленных знакомых подрос на двадцать сантиметров уже в возрасте восемнадцати лет, - и, слава богу, иногда их надежды сбываются. А иногда - нет, и человек навсегда остается, мягко говоря, ниже среднего роста. Это - болезнь, и болезнь, прямо связанная с системой биохимической регуляции.
Дело в том, что рост органов управляется особым гормоном, который так и называется "гормон роста", или иначе - соматотропин. Этот гормон имеет пептидно-белковую природу, однако назвать его пептидным все же затруднительно: молекула соматотропина представляет собой щепочку из более чем сотни аминокислотных остатков, так что это скорее белок, чем пептид. В начальный период жизни в организме должен поддерживаться определенный вровень концентрации соматотропина: устойчивое превышение такого уровня означает ускорение роста, акселерацию вплоть до возможного развития гигантизма (тоже болезнь), понижение - замедление роста.
В свою очередь, уровень концентрации соматотропина регулируется еще одним пептидом, способным блокировать процесс выделения соматотропина в кровь. В этом пептиде расчитывается четырнадцать аминокислотных остатков, он называется соматостатином и имеет аминокислотную последовательность вида: 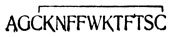 , то есть, как и окситоцин, является циклическим соединением с циклом, замкнутым между атомами серы боковых цепей двух остатков цистина. Понимание того, как действует соматостатин в организме и, в частности, как организовано его взаимодействие с рецепторами (а значит, и выяснение его конформационных особенностей), могло бы открыть путь к лекарственным средствам для борьбы с патологическими замедлениями роста; ясно поэтому, что пептидные драг-дизайнеры заинтересовались соматостатином.
, то есть, как и окситоцин, является циклическим соединением с циклом, замкнутым между атомами серы боковых цепей двух остатков цистина. Понимание того, как действует соматостатин в организме и, в частности, как организовано его взаимодействие с рецепторами (а значит, и выяснение его конформационных особенностей), могло бы открыть путь к лекарственным средствам для борьбы с патологическими замедлениями роста; ясно поэтому, что пептидные драг-дизайнеры заинтересовались соматостатином.
Наибольший успех при этом выпал на долю исследователей из США, работающих в известной фирме "Мерк". Изучение пептидных и белковых молекул в лабораториях этой фирмы возглавляет Р. Хиршманн: на страницах нашей книги его фамилия еще не встречалась, но результаты его деятельности уже упоминались. Именно он руководил группой синтетиков, поставивших в 1969 году мировой рекорд по длине аминокислотной последовательности, полученной химическим синтезом, - 124 аминокислотных остатка белка рибонуклеазы А. Непосредственно соматостатином занялся доктор Д. Вебер с ближайшими сотрудниками, и исследуют его начиная с 1976 года до настоящего времени.
Основные усилия Д. Вебер направил на поиск биологически активной конформации соматостатина, причем главными его методами были синтез и испытания активности конформационно-ограниченных аналогов молекулы. Выбор таких аналогов отличался, как мы увидим далее, снайперской точностью, обусловленной тщательными размышлениями и хорошим знанием конформационных особенностей отдельных аминокислотных остатков.
Здесь надо сказать, что уже при самом своем возникновении в конце 60-х годов теоретический конформационный анализ пептидов прежде всего изучил возможные конформации так называемых монопептидов, соединений, состоящих из двух пептидных групп, присоединенных справа и слева к боковой цепи.
Оказалось, что допустимые конформации остова монопептидов с асимметрическими "левыми" боковыми цепями примерно одинаковы для большинства аминокислотных остатков, встречающихся в природных пептидах. Исключение составляют остаток пролина (Р) и симметрическая аминокислота глицин (G). В то же время устойчивые конформации монопептидов с "правыми" боковыми цепями существенно иные, чем у соответствующих "левых" антиподов. Учитывая эти обстоятельства, иногда можно заранее предвидеть изменения пространственной структуры пептидной цепи при замене обычной асимметрической "левой" аминокислоты на пролин, глицин или "правый" изомер, но только изменения непосредственно в том положении, в котором произошла замена: пространственная структура молекулы в целом может сохраниться.
Имея в виду эти соображения, Д. Вебер и приступил к планированию синтеза конформационно-ограниченных аналогов соматостатина. Экспериментальные физико-химические данные давали основание полагать, что, как и в случае окситоцина, циклическая часть молекулы напоминает четырехугольник, в вершинах которого находятся остатки С3 и С14, а с другой стороны - соседние аминокислоты W8 и К9; кроме того, было известно, что первые остатки: A1 и G2 могут быть "отрезаны" без ущерба для активности молекулы. Поэтому первый аналог, синтезированный Д. Вебером с сотрудниками, был таким:  (греческая буква ε обозначает здесь эпсилон-аминокапроновую кислоту; это название ничего не скажет широкому читателю, но химики знают, что это очень удобный "мостик" для соединения начальной и конечной функциональных групп пептидного остова).
(греческая буква ε обозначает здесь эпсилон-аминокапроновую кислоту; это название ничего не скажет широкому читателю, но химики знают, что это очень удобный "мостик" для соединения начальной и конечной функциональных групп пептидного остова).
Новый аналог был полностью активным, и следующим шагом Д. Вебер попытался закрепить предполагаемый биологически активный "четырехугольник": к тому времени исследования пространственной структуры показали, что такая конформация стабилизируется, если в одной, вполне определенной вершине "четырехугольника" заменить "левый" остаток на такой же "правый". В соответствии с этим был проведен синтез аналога  ("правая" аминокислота W подчеркнута), который проявил активность еще большую, чем природный пептид. Этот результат имел принципиальное значение, поскольку подтверждал гипотезу биологически активного "четырехугольника". В такой конформации сближенными должны были быть остатки N5 и Т12; при этом характер их боковых цепей, как было установлено ранее, не влиял на проявления активности соматостатина. И Д. Вебер принимает смелое решение: еще более закрепить биологически активную конформацию, заменив остатки N5 и T12 на цистины с образованием между ними валентной связи. В итоге получился "бицикл"
("правая" аминокислота W подчеркнута), который проявил активность еще большую, чем природный пептид. Этот результат имел принципиальное значение, поскольку подтверждал гипотезу биологически активного "четырехугольника". В такой конформации сближенными должны были быть остатки N5 и Т12; при этом характер их боковых цепей, как было установлено ранее, не влиял на проявления активности соматостатина. И Д. Вебер принимает смелое решение: еще более закрепить биологически активную конформацию, заменив остатки N5 и T12 на цистины с образованием между ними валентной связи. В итоге получился "бицикл"  , опять-таки сохраняющий полную активность соматостатина.
, опять-таки сохраняющий полную активность соматостатина.
Исследователи попробовали еще более сузить размер "внутреннего" цикла, и вновь им сопутствовала удача: аналог  по-прежнему был высокоактивным (буквой γ здесь обозначена гамма-аминомасляная кислота, сама по себе не встречающаяся в природных пептидах). Но зато перемещение "внутреннего" цикла, несимметричное относительно "центральных" остатков "четырехугольника" - WK, к успеху не привело, поскольку у аналога
по-прежнему был высокоактивным (буквой γ здесь обозначена гамма-аминомасляная кислота, сама по себе не встречающаяся в природных пептидах). Но зато перемещение "внутреннего" цикла, несимметричное относительно "центральных" остатков "четырехугольника" - WK, к успеху не привело, поскольку у аналога  было зафиксировано снижение активности.
было зафиксировано снижение активности.
Значит, главное - это правильно зафиксировать изгиб цепи остова вокруг остатков WK, входящий в состав биологически активной конформации молекулы, без чего утрата активности неизбежна. Но, может быть, такое условие, необходимое для проявления биологического эффекта, является и достаточным? Это предположение было проверено синтезом аналога 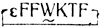 , сохранившего довольно высокую активность, но уступающего активным "бициклическим" соединениям. Поэтому Д. Вебер вернулся к идее "бицикла", и действительно аналог
, сохранившего довольно высокую активность, но уступающего активным "бициклическим" соединениям. Поэтому Д. Вебер вернулся к идее "бицикла", и действительно аналог  превзошел по своему биологическому действию как природный пептид, так и все предыдущие циклические аналоги.
превзошел по своему биологическому действию как природный пептид, так и все предыдущие циклические аналоги.
Но мало того, последний из "бициклов", как легко понять, является соединением, весьма жестким по своей пространственной структуре, и можно ожидать, что не только в комплексе с рецепторами, но и в растворе у него сохранится один предпочтительный тип конформации.
Тогда по результатам физико-химических экспериментов легко составить довольно определенное представление об этой конформации и воссоздать ее модель, которая в отличие от "модели Вальтера" уже не будет усредненным "кентавром". Д. Вебер построил подобную модель и с помощью ЭВМ попытался отыскать пептид минимальной длины, которому можно было бы придать форму построенной модели. Таким пептидом оказался циклоаналог 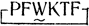 , сохранивший, как было показано впоследствии, активность, сравнимую с активностью самого соматостатина.
, сохранивший, как было показано впоследствии, активность, сравнимую с активностью самого соматостатина.
Вот и получилось в полном противоречии с законами формальной логики, что шесть аминокислот последнего аналога равняются четырнадцати аминокислотам природного соматостатина. То есть за счет удачного закрепления биологически активной конформации размер молекулы сократился более чем наполовину! Согласитесь, уже только это достижение драг-дизайнеров можно само по себе считать выдающимся. А ведь еще ничего не сказано о высокой селективности действия синтезированных циклоаналогов: они влияют на концентрацию в крови гормона роста и некоторых других гормонов, но не затрагивают, напримep, секрецию желудочного сока, что свойственно немодифицированному соматостатину. Самый короткий из "бициклов", кроме того, еще и устойчив по отношению к "нападениям" ферментов-пептидаз, причем настолько, что его можно принимать внутрь просто как обыкновенную таблетку.
Но главное для драг-дизайнеров все же то, что на этом примере с блеском были подтверждены еще и сейчас неубедительные для некоторых химиков соображения о пользе исследований конформационно-функциональных отношений пептидных биорегуляторов и, в частности, их биологически активных конформаций.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'