
Трехмерные молекулы
Если заглянуть в словарь иностранных слов, можно узнать, что топологией называют часть математики, изучающую различные свойства пространственных фигур; если к тому же поговорить с математиками, то обнаружится, что топология XX века - это весьма динамичная и крайне сложная для восприятия наука. Помимо прочих причин, сложность понимания топологических истин обусловлена одним принципиальным ограничением: человеческий мозг не в силах наглядно вообразить себе уже даже четырехмерный объект, а топологи обычно оперируют понятиями многомерного пространства.
Что получается, когда пытаешься все-таки представить, как может выглядеть фигура в пространстве многих измерений, лучше всего, пожалуй, изображено на рисунках профессионального тополога, доктора физико-математических наук А. Фоменко, которые изредка появляются на страницах научно-популярных журналов: линии, уходящие в никуда, орнаменты поверхностей, изогнутых самым причудливым образом, замкнутые формы, напоминающие валуны на берегах северных морей, со странно искаженными и тем не менее гармоничными пропорциями... От этих рисунков веет чем-то неземным, космическим, и кажется, что и впрямь чувствуешь ледяное дыхание самой Топологии, которая, как и вся Математика, все-таки есть, что бы там ни говорили философы, "химера" разума, ее породившего.
По счастью, нас не должна устрашать перспектива вообразить непредставимое: мы в отличие от математиков находимся во вполне реальном мире биологических молекул пептидной природы, которые, как и подавляющее большинство физических объектов, прекрасно чувствуют себя в обычном трехмерном пространстве.
Следовательно, топология молекул, то есть, в нашем случае, изучение возможного взаимного пространственного расположения различных функциональных групп молекулы, использует всего три измерения, и пространственные формы, образуемые молекулярными цепочками, нетрудно не только представить мысленно, но и воспроизвести "в натуре" с помощью специально выпускаемых моделей молекул или, в худшем случае, просто мягкой проволоки. Так что не существует никаких принципиальных запретов со стороны человеческого мышления на исследования пространственного строения пептидных молекул. Однако, прежде чем приступать к исследованию, неплохо чуть подробнее затронуть вопрос о его целесообразности, то есть о том, зачем нужно знать пространственные формы пептидов с точки зрения драг-дизайна.
В конце предыдущего раздела уже промелькнуло упоминание о важности именно пространственного, а не линейного строения пептидной молекулы для комплексообразования с рецептором. Надо надеяться, что это упоминание не вызвало каких-либо внутренних возражений: ведь если даже не выходить из рамок аналогии ключ - замок, то и тогда ясно, что ключ вовсе не обязан быть непременно плоским и линейным: мало ли мы видели детективных фильмов, где элегантный преступник искусно отпирает сложнейший замок сейфа, демонстрируя изготовленную на наших глазах отмычку из причудливо изогнутой канцелярской скрепки!
Форма ключа, что вполне очевидно, определяется устройством замка, и нельзя представлять себе ту часть рецептора, которая соединяется с пептидом, неизменно прямой прорезной щелью, где от рецептора к рецептору варьируется лишь глубина прорези на отдельных участках. Даже чисто умозрительно более убедительным будет предположение о том, что "прорезь" на поверхности рецептора, в которую должен быть "вставлен" пептид, может иметь самую различную форму. Благодаря этому, во-первых, один рецептор получает возможность быть отличным от другого, и, во-вторых, те части пептида и рецептора, контакт между которыми приводит к активации последнего, оказываются в непосредственной близости, и молекулярные процессы, вызывающие биологическую реакцию, приводятся в действие.
Допустим, например, что элемент "рецептора", определяющий специфичность его взаимодействия с "пептидом", - это выемка на внешней поверхности, выполненная в форме равностороннего треугольника с плоским дном и высверленным отверстием вблизи одной из вершин; допустим также, что в глубине отверстия находится нечто вроде кнопки, нажатие на которую будет означать "запуск" биологического ответа. В таких условиях эффективным станет лишь тот пептид, одна из "граней" которого также имеет вид равностороннего треугольника с соответствующим размером сторон и со шпеньком, расположенным в точном соответствии с отверстием на "рецепторе".

Проход через...
Ни "круглые", ни "квадратные" пептиды не подойдут в выемки на рецепторе, молекулы с треугольными "гранями" могут быть тоже отвергнуты из-за неподходящего размера сторон или величин углов; наконец, даже если какой-то пептид идеально впишется в выемку своей "гранью", может статься, что желаемый эффект так и не наступит из-за отсутствия на "грани" шпенька в нужном месте (последний вариант, как легко догадаться, соответствует пептиду - конкурентному антагонисту).
Короче говоря, комплементарность поверхностей пептида и рецептора, от четкого соблюдения которой зависит эффективность образования пептид-рецепторного комплекса, а следовательно, и проявление биологической активности, осуществляется за счет взаимной подгонки пространственных форм участников обсуждаемого молекулярного акта. Именно поэтому исследование таких форм представляет собой важную задачу пептидного драг-дизайна, ставшую сегодня чрезвычайно актуальной. Но, как мы уже не раз с грустью отмечали, детальное исследование строения рецепторов пептидных биорегуляторов на молекулярном уровне пока недоступно. Значит, тем большее значение приобретает изучение трехмерного строения второго участника пептид-рецепторного взаимодействия - пептидной молекулы: методы и результаты этого изучения как раз и будут составлять основную тему нашего рассказа на протяжении данной главы.
И начнем мы с самого простого: еще раз перепишем схематическую формулу пептидной цепочки, но уже чуть-чуть по-другому:
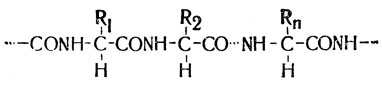
для того, чтобы стало понятней, что центральные атомы углерода (С), расположенные в местах ответвления боковых цепей R от пептидного остова (будем надеяться, что эти термины еще не забыты), обладают, как говорят химики, четырьмя заместителями, причем все заместители у них разные. Действительно, по формуле видно, что каждый такой атом окружен следующими атомами или функциональными группами: амидом NH, боковой цепью R, карбонилом СО и водородным атомом Н - все они присоединены к центральному атому С палочками, символизирующими валентные связи.
В данный момент нам вполне достаточно представления о молекуле как о системе шариков-атомов, соединенных стерженьками - валентными связями. Хотелось бы лишь напомнить, что валентные связи бывают одинарные, двойные и так далее, от чего зависит прочность стерженьков и еще кое-какие свойства молекул; что длина связей, понимаемая как расстояние между центрами соответствующих атомов, практически не меняется (во всяком случае, в рассматриваемых процессах); что величины валентных углов, образованных стерженьками-связями, принимают значения (тоже почти постоянные) от прямого до полностью развернутого угла, в зависимости от типа образующих пары связей.
Вооруженные этими знаниями, вернемся к исходной схематической формуле и попытаемся мысленно расположить перечисленные ранее четыре заместителя вокруг центрального углерода так, чтобы валентные углы между каждой парой валентных связей из четырех, указанных в формуле (всего возможно шесть пар), были примерно равны друг другу.
С непривычки это абстрактное стереометрическое упражнение может с первого раза и не получиться, так что имеет смысл использовать вполне конкретную подсказку: молочный пакет. Все знакомы с этой четырехгранной пирамидой, каждая грань которой представляет собой равносторонний треугольник, но, возможно, правильное название такой пирамиды - тетраэдр - известно не всем.
(Заметим в скобках, что изобретение и внедрение в нашу повседневную жизнь тетраэдрического молочного пакета вызвало и продолжает вызывать неоднозначную реакцию потребителей. Одни хвалят пакет за удобство создания плотной упаковки молочной тары при перевозке и решение проблемы сдачи пустых бутылок, другие клянут его за ненадежность, выливающуюся в буквальном смысле слова в молочные реки. Но есть очень узкая группа потребителей, для которых эффект появления в быту тетраэдрического пакета можно сравнить разве что с манной небесной: это популяризаторы любых научных проблем, связанных с органической химией. В самом деле, тетраэдрическое расположение заместителей вокруг атома углерода есть основа основ многочисленных и чрезвычайно интересных химических явлений, но попробуйте объяснить, что это такое, человеку, не обладающему специальной подготовкой! Здесь необходим простой и удобный пример тетраэдра, но его-то в "допакетные" времена и не было. И недаром, наверное, популярные книги на молекулярно-химико-биологические темы стали появляться десятками лишь в последние годы, причем только в немногих из них не фигурирует молочный пакет в качестве модели углеродного атома.)
Так вот, если поместить центральный атом С в центре пакета-тетраэдра, а четыре заместителя - на четырех вершинах, то соединяющие их валентные связи как раз и разместятся требуемым образом и все шесть валентных углов, имеющих своей вершиной атом С, будут равны между собой. В результате мы получим модель, довольно точно отражающую реальное пространственное строение очень важного узла пептидной цепочки - центрального тетраэдрического (этот термин является совершенно официальным) углеродного атома, соединяющего две плоские пептидные группы CONH. Если теперь, с учетом сказанного, представить себе, что пептидный остов молекулы, представленной нашей схематической формулой, лежит в плоскости книжной страницы (то есть все треугольники NH-С-СО лежат в одной плоскости), то боковые цепи R и атомы водорода Н неизбежно должны выходить из нее, причем по разные стороны: плоскость треугольника R-С-Н всегда перпендикулярна плоскости треугольника NH-С-СО.
Если уложить треугольник NH-С-СО в плоскость страницы так, чтобы атом углерода находился сверху, то перпендикулярный ему треугольник R-С-Н можно расположить в соответствии с "правилом тетраэдра" двумя эквивалентными способами: атом Н может выступать из плоскости страницы в нашу сторону либо находиться за этой плоскостью. В случае свободных аминокислот такие два варианта пространственного строения (они имеют общее название энантиомеры) выглядят в так называемых ньюменовских проекциях примерно следующим образом:
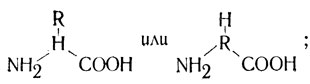
здесь центральный атом С не виден, поскольку рассматривается вид аминокислоты "сверху", вдоль связей Н-С или R-С соответственно,, и эти группы заслоняют атом углерода.
Указанные варианты строения аминокислоты не отличаются друг от друга ни молекулярной массой, ни химическими особенностями, ни затратами энергии, необходимыми для их синтеза, - решительно ничем, кроме малосущественных оптических свойств. И тем более удивителен тот факт, что в живой природе синтезируется исключительно одна из этих пространственных форм, именно вторая из изображенных, называемая "левой" минокислотой: ее энантиомер, "правая" аминокислота, хоть и встречается изредка в природных пептидах, но только как результат действия ферментов, меняющих местами группы R и Н уже после включения аминокислоты в пептидную цепь.
Отмеченному явлению подавляющего преобладания в живых организмах одного из двух возможных энантиомеров молекул (помимо аминокислот, таким же свойством обладают, например, сахара), впервые обнаруженному Л. Пастером и известному как молекулярная асимметрия, посвящено немало чисто научных и научно-популярных сочинений (среди последних автор настоятельно рекомендует читателям книгу доктора биологических наук С. Галактионова "Асимметрия биологических молекул"). И понятно почему: это явление не только удивительно само по себе, но и ставит сразу целый ряд вопросов, затрагивающих основы современного естествознания. Дело прежде всего в том, что молекулярную асимметрию в организме действительно невозможно объяснить, исходя только из представлений физики и химии: успешное функционирование в живых системах лишь "левых" аминокислот (или "правых" сахаров) обусловлено именно сложностью этих систем, то есть в конечном счете эволюционным отбором, сугубо биологическим фактором, аналога которому не найти ни в физике, ни в химии.
А раз так, значит, свойство молекулярной асимметрии есть одно из характернейших свойств живого; можно сказать даже, что лишь система, способная различать зеркальные антиподы молекул (представив, что плоскость NH2-С-СООН зеркальна, легко убедиться, что "правая" аминокислота есть отражение "левой", в этой плоскости), достойна того, чтобы считаться по-настоящему живой.
Но как в таком случае быть с проблемой возникновения жизни: существующая теория предбиологической эволюции предусматривает, что начальные элементы живого, в том числе и аминокислоты, могли образоваться сами собой в мелководных лагунах первичного океана при разряде молний в первичной атмосфере Земли, и эксперименты, моделирующие такие "доисторические" условия, оправдывают эту точку зрения. Однако аминокислоты, получающиеся в подобных опытах (как, впрочем, практически в любых химических экспериментах), представляют собой так называемый рацемат, смесь равных количеств "левого" и "правого" изомеров. Чтобы отобрать какой-либо один сорт из этой смеси, необходимо существование молекулярной системы, не менее сложной, чем простейший живой организм. Такая необходимость окончательно замыкает порочный круг типа "для зарождения живого требуется наличие живого", который может быть разорван теперь только за счет дополнительного предположения. Но какого?
Вот в какие дебри, и вовсе не только биологические, а общефилософские, завело нас упоминание об асимметрии биологических молекул. Но мы не будем погружаться далее в столь высокие материи; подчеркнем лишь еще раз, что молекулярная машина организма использует для своего нормального жизненного цикла энантиомеры строго определенного типа, то есть является, как принято говорить, стереоспецифичной. При этом стереоспецифичным в ней оказывается также и чрезвычайно эффективное воспроизводство энантиомеров. А между тем жесточайшим врагом пептидных химиков (о чем в соответствующем разделе не говорилось) считается высокая степень самопроизвольного перехода тщательно отобранных "левых" энантиомеров аминокислот в их "правую" форму просто как следствие их включения в пептидную цепь.
Короче говоря, пространственное строение пептидной молекулы играет важную роль для проявления ее биологических функций уже в силу наличия в ней асимметрических центров - атомов углерода, принадлежащих "левым", а не "правым" аминокислотам. Но это не единственный и даже не самый главный источник "объемности" структуры пептидов: основной вклад в создание пространственной формы молекулы вносит возможность внутримолекулярного вращения отдельных частей молекулы друг относительно друга, причем осями вращения могут служить любые одинарные валентные связи.
Так, вокруг трех валентных связей, исходящих из центрального углеродного атома (NH-С; С-СО и С-R) также допустимы внутренние вращения; валентные структуры различных типов боковых цепей R, в свою очередь, содержат одинарные связи, и, следовательно, подобные вращения происходят и в боковых цепях.
(Формально говоря, вращается и "шарик" атома Н вокруг забытой нами оси С-Н, но понятно, что такое вращение никак не изменяет общую пространственную организацию молекулы.)
В результате оказывается, что пептидная молекула вовсе не является той жесткой линейной цепочкой, строение которой иллюстрируется схематической формулой, приведенной несколькими страницами ранее; напротив, она должна скорее напоминать "молекулярный шарнир" - механическую систему, способную изгибаться в пространстве самым причудливым образом, образуя разнообразнейшие типы пространственных форм: на профессиональном языке они называются конформациями.
Таким образом, мало того, что пептид является "объемным" трехмерным объектом, он может еще и существовать в нескольких ипостасях различных пространственных форм-конформаций. От осознания этого факта до гипотезы о том, что именно одна из конформаций (или несколько избранных конформаций) пептидной молекулы, а не ее аминокислотная последовательность, обусловливает комплементарность молекулы специфическому рецептору и, значит, их комплексообразование,- один шаг, и исследователи, сделавшие этот шаг, были щедро вознаграждены за затраченные усилия. Действительно, сразу становятся понятными многие экспериментальные факты, необъяснимые в рамках линейной теории. Например, случаи удаления от "активного центра" вдоль пептидной цепи отдельных аминокислотных остатков, несущих сигнатуру активации рецептора: такие остатки вполне могут быть расположены рядом с "активным центром" в пространстве и взаимодействовать с рецептором в том же месте, что и "активный центр".
(Кстати, аналогичная ситуация характерна и для многих белков-ферментов. Скажем, в молекуле лизоцима, фермента, расщепляющего сахара определенного сорта, в собственно акте расщепления принимают участие аминокислоты со следующими номерами вдоль цепи: 20-23, 28, 34-37, 40-64, 68-75, 98-123.)
Очевидным делается и представление об эквифункциональных аминокислотных заменах, сохраняющих сигнатуру комплексообразования с рецептором: к числу таковых следует теперь относить лишь замены, не меняющие конформационные свойства пептида. Можно было бы привести еще и другие подобные примеры, но все они так или иначе отражают одну и ту же закономерность развития пептидного драг-дизайна: необходимость перехода к исследованию конформационно-функционалъной, а не только структурно-функциональной организации пептидных биорегуляторов.
Эта закономерность настолько важна, что ее осознание смело можно считать самым значительным достижением в сравнительно недолгой истории драг-дизайна пептидов, причем достижением непреходящим: какие бы факторы ни повлияли в дальнейшем на процесс конструирования будущих фантастически эффективных пептидных аналогов, требование их пространственной комплементарности специфическому рецептору сохранится. Поэтому вполне естественно будет посвятить следующую главу нашей книги исключительно вопросам, связанным с конформационно-функциональной организацией биорегуляторов пептидной природы.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'