
Холиеэстераза и ацетилхолин
Согласно существующим представлениям, в основе механизма действия ФОС лежит избирательное торможение ими фермента ацетилхолинэстеразы, или просто холинэстеразы, которая катализирует гидролиз ацетилхолина-химического передатчика (медиатора) нервного возбуждения. Различают 2 типа холинэстеразы: истинную, "содержащуюся преимущественно в тканях нервной системы, в скелетной мускулатуре, а также в эритроцитах, и ложную, содержащуюся главным образом в плазме крови, печени и некоторых других органах. Собственно ацетилхолинэстеразой является истинная, или специфическая, холинэстераза, так как только она гидролизует названный медиатор. И именно ее в дальнейшем мы будем обозначать термином "холинэстераза". Поскольку фермент и медиатор являются необходимыми химическими компонентами передачи нервных импульсов в синапсах - контактах между двумя нейронами или окончаниями нейрона и рецепторной клеткой, следует более подробно остановиться на их биохимической роли.
Ацетилхолин синтезируется из спирта холина и ацетилкоэнзима А* под влиянием фермента холинацетилазы в митохондриях нервных клеток и накапливается в окончаниях их отростков в виде пузырьков диаметром около 50 нм. Предполагается, что каждый такой пузырек содержит несколько тысяч молекул ацетилхолина. При этом в настоящее время принято различать ацетилхолин, готовый к секреции и расположенный в непосредственной близости от активной зоны, и ацетилхолин вне активной зоны, находящийся в состоянии равновесия с первым и не готовый к выделению в сипаптическую щель. Кроме того, имеется еще так называемый стабильный фонд ацетилхолина (до 15%), не освобождающегося даже в условиях блокады его синтеза.** Под воздействием нервного возбуждения и ионов Са2+ молекулы ацетилхолина переходят в синаптическую щель - пространство шириною 20-50 нм, отделяющее окончание нервного волокна (пресинаптическую мембрану) от иннервируемой клетки. На поверхности последней расположена постсинаптическая мембрана с холинорецепторами - специфическими белковыми структурами, способными взаимодействовать с ацетилхолином. Воздействие медиатора на холинорецептор приводит к деполяризации (снижению заряда), временному изменению проницаемости постсинаптической мембраны для положительно заряженных ионов Na+ и проникновению их внутрь клетки, что в свою очередь выравнивает потенциал напряжения на ее поверхности (оболочке).*** Это дает начало новому импульсу в нейроне следующей ступени или вызывает деятельность клеток того или иного органа: мышцы, железы и др. (рис 5). Фармакологические исследования выявили существенную разницу в свойствах холинорецепторов различных синапсов. Рецепторы одной группы, проявляющие избирательную чувствительность к мускарину (яду гриба мухомора), названы мускариночувствительными, или М-холинорецепторами; они представлены главным образом в гладких мышцах глаз, бронхов, желудочно-кишечного тракта, в клетках потовых и пищеварительных желез, в сердечной мышце. Холинорецепторы второй группы возбуждаются малыми дозами никотина и поэтому названы никотино-чувствительными, или Н-холинорецепторами. К ним относятся рецепторы вегетативных ганглиев, скелетных мышц, мозгового слоя надпочечниковых желез, центральной нервной системы.
*( Ацетилкоэнзим А - соединенно уксусной кислоты с нуклеотпи дом, включающим несколько аминокислот и активную SН-группу. Отщепляя ацетат, идущий на построение молекулы ацотилхолина, он превращается в коэнзим А)
**( Глебов Р. Н., Примаковский Г. Н, Функциональная биохимия синапсов. М.: Медицина, 1978 )
***( Согласно установившейся точке зрения, возникновение разности потенциалов между наружной и внутренней сторонами поверхностного сдоя клетки обусловлено неравномерным распределением ионов Na+ и К+ по обе стороны клеточной мембраны. При этом компенсирующий поток ионов К+, направленный в обратную сторону при воздействии медиатора на постсинантическую мембрану, несколько запаздывает, что приводит на короткое время к обеднению внешней поверхности клетки положительными ионами )
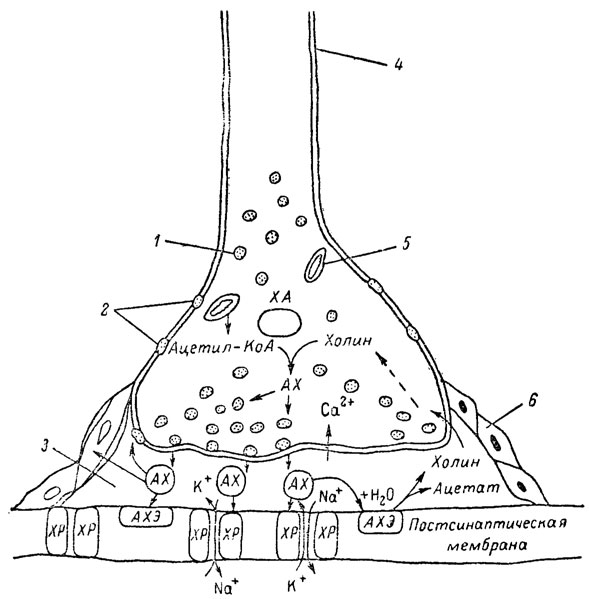
рис. 5. Основные структурные элементы и схема функционирования холинергического синапса (Голиков, Фишзон-Рысс, 1978). 1 - синаптические пузырьки; 2 - пресинаптические центры связывания ацетилхолина; 3 - синаптическая щель; 4 - миелиновая оболочка; 5 - митохондрии; 6 - шванновские клетки; ХР - холинорецептор; АХ - ацетил-холин; АХЭ - ацетилхолинэстераза; ХА - холинацетилаза
Молекулы ацетилхолина, выполнившие свою медиаторную функцию, должны быть немедленно инактивированы, в противном случае будет нарушена дискретность в проведении нервного импульса и проявится избыточная функция холинорецептора. Именно это осуществляет холинэстераза, мгновенно гидролизующая ацетилхолин. Каталитическая активность холинэстеразы превышает почти все известные ферменты: по разным данным, время расщепления одной молекулы ацетилхолина составляет около одной миллисекунды, что соизмеримо со скоростью передачи нервного импульса. Осуществление столь мощного каталитического эффекта обеспечивается наличием в молекуле холинэстеразы определенных участков (активных центров), обладающих исключительно хорошо выраженной реакционной способностью по отношению к ацетилхолину.* Будучи простым белком (протеином), состоящим только из одних аминокислот, молекула холинэстеразы, как теперь выяснено, исходя из ее молекулярной массы, содержит от 30 до 50 таких активных центров.
*( Розенгарт В. И. Холинэстеразы. Функциональная роль и клиническое значение. - В кн.: Проблемы медицинской химии. М.: Медицина, 1973, с. 66-104)
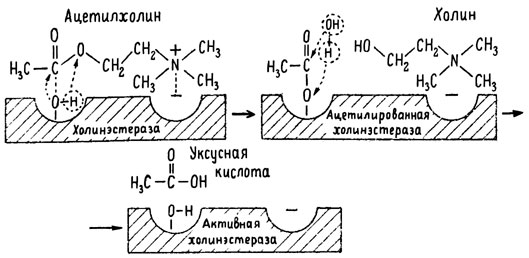
рис. 6. Ферментативный гидролиз ацетилхолина. Объяснение в тексте
Как видно из рис. 6, участок поверхности холинэстеразы, непосредственно контактирующий с каждой молекулой медиатора, включает 2 центра, расположенных на расстоянии 0,4-0,5 мм: анионный, несущий отрицательный заряд, и эстеразный. Каждый из этих центров образован определенными группами атомов аминокислот, составляющих структуру фермента (гидроксилом, карбоксилом и др.). Ацетилхолин благодаря положительно заряженному атому азота (так называемой катионной головки) ориентируется за счет электростатических сил на поверхности холинэстеразы. При этом расстояние между атомом азота и кислотной группой медиатора соответствует расстоянию между активными центрами фермента. Анионный центр притягивает к себе катионную головку ацетилхолина и тем самым способствует сближению его эфирной группировки с эстеразным центром фермента. Затем рвется эфирная связь, ацетилхолин разделяется на 2 части: холиновую и уксусную, остаток уксусной кислоты присоединяется к эстеразному центру фермента и образуется так называемая ацетилирозанная холинэстераза. Этот крайне непрочный комплекс мгновенно подвергается спонтанному гидролизу, что освобождает фермент от остатка медиатора и приводит к образованию уксусной кислоты. С данного момента холииэстераза снова способна выполнять каталитическую функцию, а холин и уксусная кислота становятся исходными продуктами синтеза новых молекул ацетилхолина.
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'