
Глава 6. Фармакологическая активность многокомпонентных растительных смесей
"Очищающие" лекарственные средства
Тибетские медики различали "очищающие" и "успокаивающие" лекарства, и лечение болезней начиналось, как правило, с очищения организма.
В 59-й гл. трактата "Лхантаб" и в 36-х главах III томов трактатов "Чжуд-ши" и "Вайдурья-онбо", посвященных описанию лечения болезней печени, приведены прописи восьми "очищающих" лекарственных смесей. В их состав в разных сочетаниях входят одни и те же средства: плоды двух видов миробалана - м. хебула и м. беллерического, а также эмблики лекарственной, корни шлемника байкальского, трава сверции чираты, клубни борца разнолистного.
Анализ лечебных свойств отдельных компонентов, включенных в "очищающие" лекарственные смеси, показал, что в их состав тибетские медики вводили средства, корригирующие функциональные состояния "рлунг", "мкхрис" и "бад-кан" отдельных органов, т. е. противовоспалительные и жаропонижающие, а также послабляющие.
Судя по имеющимся в литературе сведениям о химическом составе и фармакологическом действии отдельных компонентов этих "очищающих" смесей, последние должны способствовать ускоренному выведению эндо- и экзотоксинов почками, печенью, кожей и легкими из организма.
Фрагменты из "очищающих" смесей мы находим в прописях лекарственных средств, назначавшихся при самых различных заболеваниях. Так, одним из эффективных составов, "очищающих полость груди от жара" и используемых при различных болезнях, сопутствующих пневмонии, считалась лекарственная смесь "Жоньши-25" - "Гипс-25" [БАЖ, л. 61]. В ее состав входят уже отмеченные нами плоды двух видов миробалана и эмблики лекарственной.
Более того, как сказано в "Чжуд-ши", "Вайдурья-онбо" и "Лхантабе", состав "Гипс-25" рекомендован для лечения болезней печени, осложненных "жаром легких".
В системе комплексной терапии кроме "очищающих" использовались также и другие лекарственные средства, при помощи которых, вероятно, достигалось восстановление нарушенных функций организма.
В качестве тонизирующих нервную и сердечно-сосудистую системы средств в состав "Гипс-25" включены мускатный орех, бутоны гвоздичного дерева, кардамон настоящий и к. средний.
Мы исследовали биологическую активность 3- и 5-компопентных сочетаний растений, которые в качестве фрагментов входят в целый ряд сложных лекарственных композиций: I - плоды миробалана хебула, боярышника кроваво-красного и яблони ягодной, II - корни девясила высокого и шлемника байкальского, плоды яблони ягодной и шиповника даурского, трава зубчатки поздней.
По БАЖ [л. 2, 3], лекарственная смесь I назначается для устранения "жара крови", последствий неправильного лечения и при "хронической лихорадке", а также широко используется в многокомпонентных лекарственных композициях для лечения болезней с осложнениями.
Состав II входит в "очищающие" средства.
Цель наших исследований - изучение биологической активности названных выше сочетаний растений, каждое из которых должно или нормализовать нейрогумораль-ные процессы, или оказывать противовоспалительное и детоксирующее действие (состав I) [ВО, т. II, гл. 20, л. 196, 197] и регулировать названные процессы, или же обладать стимулирующим действием (состав II) [ВО, л. 197, 199, 202, 203, 205] (табл. 24, 25).

Таблица 24. 'Очищающие' средства и показания к применению их компонентов
Согласно современным представлениям о фармакологической регуляции регенераторных процессов, большинство используемых лекарственных средств оказывает однонаправленное действие, восстанавливая при этом морфологическую структуру или обеспечивая адекватную функциональную активность органа за счет мобилизации сохранившихся клеточных структур [Саркисов, 1976; Урываева, 1979]. В связи с этим интересно было выяснить возможность поливалентного действия многокомпонентных лекарственных смесей, составленных по тибетским прописям.

Таблица 25. Состав 'Жоньши-25', 'полностью побеждающий слизь'
В опыт было взято три группы крыс-самцов массой 150-170 г. Первую группу (контроль) составляли интактные крысы, которым перорально и подкожно вводили физиологический раствор. У животных второй группы вызывали токсический гепатит трехкратным подкожным введением тетрахлорметана (0,25 мл/100 г массы) и перорально вводили физиологический раствор. У животных третьей группы также вызывали токсический гепатит и одновременно с лечебно-профилактической целью в течение первых 3 сут вводили отвар лекарственной смеси I, а начиная с 4-х суток эксперимента - отвар лекарственной смеси II. Обе смеси из расчета на сухо-воздушное сырье применяли в дозе 0,2 г/100 г массы. Об экскреторной функции печени судили по клиренсу бромсульфалеина, вводимого внутривенно в дозе 50 мг/кг массы [Гацура, 1974].
Степень повреждения мембранных структур гепатоцитов оценивали по накоплению одного из конечных продуктов перекисного окисления липидов - малонового диальдегида (МДА)-в гомогенатах печени [Стальная, Гаришвили, 1977], а также по активности трансаминаз - маркерных ферментов цитоплазматических мембран. Для оценки гистологической структуры срезы тканей печени окрашивали гематоксилин-эозином. Активность внутриклеточной регенерации определяли по ядерно-цитоплазматическому отношению [Вейбель, 1970; Автандилов, 1980].
Результаты наблюдений за экскреторной функцией печени крыс на 7-е и 14-е сутки после введения лекарственных смесей I и II (табл. 26) показывают, что детоксирующая способность печени у крыс второй группы по сравнению с контрольной была снижена на протяжении всего эксперимента, а у животных третьей группы клиренс бромсульфалеина существенно возрастал.

Таблица 26. Коэффициент ретенции бромсульфалеина, мг%
(Примечание. Здесь и в табл, 27 группы животных: 1 (контрольная) - интактные, которым перорально и подкожно вводили физиологический раствор; 2 - с токсическим гепатитом, получавшие перорально физиологический раствор; 3 - с токсическим гепатитом, получавшие перорально лекарственные смеси I и II. Р, - критерий достоверно" сти различий между показателями животных групп 1 и 2, Рг - животных групп 2 и 3)
Приведенные в табл. 27 данные свидетельствуют о значительном повышении активности трансаминаз в сыворотке крови по мере развития экспериментального гепатита. Введение животным комплексных лекарственных смесей достоверно снижало уровень ферментемии, что указывает на выраженный фармакотерапевтический эффект.

Таблица 27. Активность АЛТ п ACT в сыворотке крови крыс, ммоль/мл
Параллельно с изменением активности трапсаминаз сыворотки крови изменялся уровень МДА в гомогенато печени. На 7-е сутки развития гепатита у животных второй группы происходило резкое повышение уровня МДА (па 335% по сравнению с интактными), который фиксировался и на 14-е сутки. Под действием тибетских лекарственных смесей накопление МДА в печени значительно снижалось: у животных третьей группы на 7-е сутки оно составляло 239%, а на 14-е - 135% от контрольного уровня МДА, что указывает на выраженное мембранно-стабилизирующее действие лекарственных смесей.
На 7-е сутки эксперимента у животных второй группы почти полностью была нарушена балочная структура печени. Выявлялись центролобулярные некрозы. Одновременно отмечались явления зернистой, жировой и вакуольной дистрофии, а также полиморфизм гепатоцитов. Ядра многих клеток подвергнуты пикнозу. О глубине дистрофических явлений свидетельствовало снижение ядерно-цитоплазматического отношения до 57% от показателя интактных животных, которое происходило за счет увеличения размеров цитоплазмы при одновременном уменьшении размеров ядра гепатоцитов. В сосудах выявлялись гемодинамические изменения в виде полнокровия и стаза. По ходу их обнаруживались клеточные инфильтраты за счет лимфогистиоцитарных элементов. Купферовекие клетки выглядели набухшими. У животных третьей группы на 7-е сутки опыта число гепатоцитов с дистрофическими и некробиотическими изменениями было значительно меньше, чем в контроле, но были заметны нарушения балочной структуры печени и дискомплексация гепатоцитов. Наряду с этим уменьшалась клеточная инфильтрация вокруг сосудов и в портальных областях. Отчетливо были видны признаки регенерации - появлялись двухъядерные клетки и митозы. Ядерно-цитоплазматическое отношение составило 105,2% по сравнению с показателями интактной группы.
На 14-е сутки эксперимента у животных второй группы сохранялись признаки острого токсического гепатита: центролобулярный некроз и дистрофические изменения гепатоцитов. Отчетливо была нарушена балочная гистоструктура органа. Сохранялись гемодинамические нарушения в сосудах и периваскулярная инфильтрация форменными элементами крови. Купферовекие клетки продолжали оставаться набухшими. Позитивный момент в динамике развития острого токсического гепатита в этот период состоял в некотором - до 89,4% от показателя интактных крыс - увеличении ядерно-цитоплазматического индекса, которое происходило за счет гипертрофии ядра. У животных третьей группы наблюдалось восстановление балочной структуры печени. Почти полностью исчезли дистрофические изменения в гепатоцитах. Ядерно-цитоплазматический индекс не только превышал этот показатель у крыс контрольной группы, но даже на 31,6% был больше, чем у интактных животных. Причем повышение показателя констатировалось на фоне одновременной гипертрофии цитоплазмы и ядра. В целом морфологическая структура печени крыс третьей группы на 14-е сутки эксперимента приближалась к таковой у интактных животных.
Таким образом, в эксперименте показано, что многокомпонентные лекарственные смеси, приготовленные по тибетским прописям, в значительной степени предотвращают изменения, вызываемые ССl4, и оказывают гепатопротекторное действие. При этом функциональная активность печени сохраняется, что свидетельствует о структурно-функциональной целостности центролобулярных образований, состоящих из наиболее дифференцированных гепатоцитов.
Известно, что достаточно высокий уровень клеточной и внутриклеточной регенерации обеспечивается за счет сохранения матричных и барьерных функций биологических мембран [Бурлакова и др., 1975]. Нами в эксперименте показано, что многокомпонентные лекарственные смеси ингибируют процессы перекисного окисления липидов, тем самым предотвращая деструкцию биологических мембран.
Полученные данные свидетельствуют о полипотентном действии использованных лекарственных смесей па структурно-функциональное состояние печени. Оно способствует сохранению гистоструктуры органа и выполнению им специфических функций, стимулируют репаративную регенерацию. Это подтверждает достоверность информации тибетских трактатов о разностороннем действии многокомпонентных смесей.
Гемостатические лекарственные средства
Лекарственная смесь "Тхаший-тханг" состоит из равных весовых количеств: травы горца птичьего, горечавки крупнолистной, зубчатки поздней и корпей оносмы песчаной. К этому составу добавляется желчь медведя, которую можно заменить желчью крупных домашних животных [БАЖ, л. 9-10].
Для приготовления все составные части берут в необходимых количествах и тщательно измельчают в порошок до размера частиц приблизительно 0,5 мм [Найдакова, 1979].
В практике тибетской медицины смесь назначали один раз в день по 0,5 г. Рабочая доза лекарственной смеси, выбранная экспериментально, составляла 1800 мг/кг. Согласно рекомендациям БАЖ смесь лекарственных растений кипятили 3 мин. В полученный отвар добавляли необходимое количество желчи. Эффективность лекарственной смеси "Тхаший-тханг" была выявлена при скрининге. Кроме того, достоинство "Тхаший-тханг" в том, что в ее составе отсутствует импортное сырье, и в простоте приготовления. В тибетской медицине эта лекарственная смесь рекомендована при кровотечениях разной этиологии: "...из носа, истечении (крови) из легких, дефектах кровеносных сосудов" [БАЖ, л. 9-10].
Качественный химический анализ лекарственной смеси "Тхаший-тханг"* показал содержание в ней разнообразных биологически активных веществ: флавоноиды (+), дубильные вещества (++), алкалоиды (++), антрахиноны ( + ), кумарины ( + ).
*(Анализы выполнепы в лаборатории химико-фармапевтических исследований Института биологии БФ СО АН СССР Л. М. Танхаевой.)
По показаниям к применению каждого из отдельных компонентов, согласно данным трактатов, трое являются собственно кровоостанавливающими (горец птичий, оносма песчаная и желчь). Присутствие горечавки крупнолистной и зубчатки поздней, по-видимому, направлено на устранение патологических явлений, сопутствующих кровотечениям (табл. 28).

Таблица 28. Свойства компонентов смеси 'Тхаший-тханг'
Рассмотрим потенциальные возможности обеспечения гемостатической активности отдельных компонентов смеси "Тхаший-тханг". Для этого приведем имеющиеся литературные данные о химическом составе каждого из названных ингредиентов и фармакологической их активности.
В листьях горца птичьего содержится флавоновый гликозид авикулярин flronchet, Vnilleman, 1964]. Кроме того, по сведениям Е. С. Bate-Smith [1962] и J. Tronchet, В. Vuilleman [1964], в траве названного растения содержатся флавоноиды: кверцетин, кемпферол, мирецетии, дельфинидин. Из стеблей выделены кумарипы скополетин и умбелиферон. Содержание флавоноидов достигает 9,1-13,4 мг/г сухой массы растения; эфирного масла - следы; каротина - 0,4 мг/г, аскорбиновой кислоты - 1,2, сахара - до 25 мг/г [Фруентов, 1972; Турова, 1974; Минаева, 1978]. Установлено, что основным действующим веществом, повышающим скорость свертывания крови, является флавоновый гликозид авикулярин [Пакудипа, Садыков, 1970]. Различные вытяжки из травы горца птичьего повышают свертывающую способность крови и обладают мочегонным действием [Алуф, Распопова, 1945; Ибрагимов и др., 1969]. На основе этого гликозида был получен препарат авикулярен, обладающий кровоостанавливающим действием [Середин, Соколов, 1969].
В экспериментах на собаках изучено гемостатическос действие сухого спиртового экстракта горца птичьего [Ибрагимов и др., 1969], который при внутривенном введении в дозе 0,1 г/кг массы тела через 30 мин ускорял свертываемость крови на 30%, а через 60 мин - на 40%. Увеличение дозы практически не влияло на гемокоагуляцию. М. А. Алуф и Т. В. Распопова [1945] в экспериментах на животных показали, что отвар, настой и экстракт из горца птичьего обладают спазмолитической и гипотензивной активностью и при этом мало токсичны. А. Д. Турова [1974] рекомендует для дальнейшего клинического изучения флавоноидную фракцию из этого растения при заболеваниях почек и печени.
В китайской и индийской медицине горец птичий используется как тонизирующее и кровоостанавливающее средство [Ибрагимов, Ибрагимова, 1960; Chopra et al., 1956].
Другой компонент препарата - зубчатка поздняя (син. з. красная) из семейства норичниковых. В траве зубчатки поздней содержатся макро- и микроэлементы К, Са, Fo, Al, Со и т. д. [Мусаева, Блинова, 1967]. Из растения выделены флавоноиды - 23,4 мг/г; иридоиды - 17,7; дубильные вещества - 35,8 мг/г массы сухо-воздушного сырья [Деготь, 1971; Гармаев и др., 1982].
В сухом экстракте зубчатки поздней, собранной в Бурятской АССР и Украинской ССР, обнаружено более 10 флавоновых гликозидов, представленных производными флавонов. Отмечено присутствие пе менее пяти окси-коричных кислот. Хроматографически выявлено до 10 разновидностей иридоидов; выделено восемь индивидуальных веществ, среди которых кофейная кислота, апигенин, лютеолин, аукубин [Деготь и др., 1979; Jahodar, 1978].
Показана эффективность препаратов из надземной части зубчатки поздней при болезнях желудочно-кишечного тракта, катарах дыхательных путей, бронхиальной астме; они используются в качестве антиревматических, мочегонных, спазмолитических средств [Jahodar, 1978]. В условиях эксперимента установлено, что настой из травы зубчатки поздней обладает кардиотоническим, гипотензивным, противосудорожным действием [Насыров, 1971].
Сухой экстракт зубчатки поздней, используемый для экспериментальной фармакотерапии крыс с тетрахлорметановым гепатитом в дозе 0,3 г/кг, увеличивал секрецию желчи, улучшал белковый и жировой обмен и оказывал мембранно-стабилизирующее действие на гепатоциты [Гармаев, Николаев, 1978; Николаев и др., 1978]. Внутривенное введение кроликам экстракта в той же дозе через 30 мин приводило к сокращению времени рекальцификации плазмы на 48% и повышению толерантности плазмы к гепарину на 43%. Через 6 ч эти показатели отличались от таковых в контроле на 22% [Хапкин, Гармаев, 1981].
Показано, что для настоя зубчатки поздней ЛД50 при внутрибрюшинном и пероральном пути введения соответственно составила 15,3 и 18,7 г/кг массы [Насыров, 1971].
Третьим компонентом лекарственной смеси "Тхашийтханг" является горечавка крупнолистная. В надземной части этого вида обнаружены флавоноиды, содержание которых в одном грамме сухого измельченного сырья зависит от фазы вегетации и колеблется от 4,9 до 10,6 мг [Галинская, 1978; Минаева, 1978]. Методом количественной хроматографии показано, что флавоноидные соединения в надземной части горечавки представлены гликозидированными формами [Галинская, 1978].
Б. А. Шухободский [1961] отметил значительное содержание алкалоидов в надземной части горечавки крупнолистной, в связи с этим рекомендовано дальнейшее ее исследование. Из надземной части этого растения выделен алкалоид генцианин [Willaman, Hui-Lindli, 1970], присутствующий в большинстве горечавковых [Никитина, 1967; Садритдинов, 1971; Belleman Jacot-Guillarraod, 1973].
Фармакологическое изучение горечавки крупнолистной показало, что она может применяться в качестве заменителя горечавки желтой - при заболеваниях органов системы пищеварения [Галинская, Гельман, 1975; Галинская, 1978]. Результаты фармакологических исследований Ф. Садритдинова [1971] показали, что алкалоиды генцианин, геициананин, генцианамин и генцианадин малотоксичны при длительном применении. По заключению А. И. Шретера [1975], перспективны дальнейшие исследования горечавки крупнолистной как кровоостанавливающего средства.
Четвертым компонентом тибетской лекарственной смеси являются корни оносмы песчаной из семейства бурачниковых. В литературе имеются сведения о том, что из многих видов этого семейства выделены алкалоиды, относящиеся к группе гелиотридана - производного метилпирролизидина [Гаммерман, Гром, 1976]. Из корней многих видов оносмы, в том числе оиосмы песчаной, выделено несколько красящих веществ, относящихся к нафтохинонам (шиконин, анхузин, алканин, алкарот) и обладающих биологической активностью [Романова и др., 1969; Тареева и др., 1969; Каrrеr, 1959]. В корнях некоторых видов опосмы обнаружены сапонины [Захаров, Боряев, 1968].
Н. И. Николаева [1947] показала на больных, что красящие вещества синтетического происхождения: метиленовый синий, генцианвиолет и конгорот - обладают тромбоцитопоэтической активностью. Р. К. Алиев [1960] подтвердил это действие на красящих веществах растений, обладающих кровоостанавливающим действием. Многие виды оносмы находят применение в пищевой и парфюмерной промышленности [Губанов, Либизов, 1970]. Имеются сведения об использовании корней видов оносмы как слабительных и противовоспалительных средств; в Индии их применяют при лечении бронхиальной астмы, лепры, сердечной аритмии [Kirtikar, Basu, 1934]. В тибетской медицине корни оносмы разных видов, арнебии, воробейника краснокорневого, принадлежащих к одному семейству бурачниковых, упоминаются в составе кровоостанавливающих прописей [БАЖ, л. 9-10].
Пятым компонентом кровоостанавливающей смеси является желчь. Исследования по выяспению ее влияния на функции организма продолжаются [Физер, Физер, 1964; Ганиткевич, 1980].
В химический состав желчи разных видов животных входят разные желчные кислоты, из которых доминирующими являются хенодезоксихолевая и литохолевая. Вместе с тем в свиной желчи содержится гиодезоксихолевая кислота, причем ее содержание составляет до 40% от общей суммы желчных кислот. Если у многих видов животных кетокислоты содержатся в следовых количествах, то в свиной желчи их концентрация достигает 20% от суммарного количества желчных кислот. Кроме того, свиная желчь содержит гиохолевую триоксикислоту.
Известно, что желчные кислоты относятся к очень важному классу природных соединений - стероидам. Эту группу биологически активных веществ кроме желчных кислот представляют гормоны, сапогениyы, многочисленные алкалоиды, сердечные гликозиды и другие вещества. В экспериментах показано, что желчь в малых дозах ускоряет свертывание крови [Ганиткевич, 1980].
Наши эксперименты выполнены на 455 крысах-самцах массой 150-170 г и на 10 беспородных собаках, содержащихся на стандартном пищевом рационе вивария. В каждой серии экспериментов в подопытную группу набирали от 6 до 16 животных.
Для характеристики функционального состояния свертывающей системы крови использовались следующие методики: время рекальцификации плазмы [Bergerhof, Roka, 1954]; толерантность плазмы к гепарину [Sigg, 1952]; потребление протромбина по М. А. Котовщиковой, 3. Д. Федоровой [1961]; протромбиновый ипдекс [Quick, 1953]; в модификации В. Н. Туголукова [1953]; активность факторов VIII [Bounameaux, 1957] и XIII [Балуда и др., 1965]; концентрация фибриногена [Андреенко, 1979]; тромбиновое время [Сирмаи, 1953].
Гемокоагуляцию цельной крови изучали на отечественном электрокоагулографе Н-333, на котором снимали показатели T1, Т2 и Т, соответственно характеризовавшие время образования активного тромбопластина, тромбина и фибринового сгустка [Вайтмахер и др., 1969].
Исследование сосудисто-тромбоцитарного гемостаза включало следующие показатели: количество тромбоцитов периферической крови [Петерс, 1976]; длительность кровотечения [Сушкевич и др., 1969]; адгезию кровяных пластинок [Moolten, Vroman, 1948], в модификации Т. А. Одесской и др. [1971].
Забор крови для исследования производили у крыс, фиксированных к операционному столику, из яремной и бедренной вен без наркоза. Костно-мозговой пунктат брали из бедренных костей. В качестве антикоагулянта in vitro использовали 3,8%-ный раствор лимонно-кислого натрия в соотношении 1 :9. У каждого животного одномоментно забирали 2,5-3 мл крови. Общая схема эксперимента представлена в табл. 29.

Таблица 29. Характеристика методов и условий эксперимента
Исследование фармакологической активности отвара лекарственной смеси "Тхаший-тханг" и ее компонентов на проницаемость обменных микрососудов брыжейки крыс проведено с применением метода "меченых" сосудов [Горизонтова и др., 1975]. При этом очищенную тушь ["Флора", г. Таллин], по 0,2 мл/100 г массы животного, вводили внутривенно и 0,1%-ный раствор гистамина гидрохлорида по 0,3 мл/100 г массы - внутрибрюшинно через 2 ч после введения отваров полной смеси и ее компонентов.
Серия экспериментов на интактных животных проведена для выявления точек фармакологического воздействия отвара на систему гемостаза. В предварительных экспериментах выяснено, что максимальное действие отвара лекарственной смеси "Тхаший-тханг" проявлялось через 2 ч, продолжительность действия отвара сохранялась в течение 28 ч. Поэтому плазменную коагуляцию и показатели сосудисто-тромбоцитарного гемостаза изучали через 2 ч и спустя 7 сут после введения отвара лекарственной смеси у крыс и собак.
В этой же серии экспериментов было предпринято исследование тромбоцитопоэтической активности донорской сыворотки крови животных, получавших отвар многокомпонентной лекарственной смеси в течение 5 дней. Использовался биологический метод определения тромбоцитопоэтической активности сыворотки крови [Баранов, 1966, 1971; Schulman, Adildgaard et al., 1965], сущность которого заключается в оценке количества прироста тромбоцитов у животных-реципиентов после внутрибрюшинного введения им 1 мл/100 г донорской сыворотки от животных, получавших отвар "Тхаший-тханг". Количество тромбоцитов изучалось через 1, 3 и 6 сут после введения интактным крысам донорской сыворотки.
При изучении мегакариоцитограммы исследовали тромбоцитообразующую функцию мегакариоцитов, разделяя их на функционирующие и нефункционирующие формы. Исследование производили через 3 сут от начала эксперимента. Описание мегакариоцитарного ростка производили в соответствии с классификацией И. А. Кассирского, П. Г. Алексеева [1970] и Sh. Ebbe [1968], согласно которой морфологически идентифицируемые мегакариоциты в костном мозге подразделяются на четыре типа клеток, представляющих собой последовательные стадии созревания: мегакариоцитобласты, мегакариоциты (базофильные, полихроматофильные, оксифильные), метамегакариоциты, свободные ядра. Учитывались также функционально активные и неактивные формы клеток [Пиксанов, Елизарова, 1969].
Одна из основных задач настоящего исследования состояла в изучении возможностей использования препарата из сырья природного происхождения с целью коррекции системы гемостаза при нарушениях ее отдельных звеньев.
Состояние гипокоагуляции крови достигается длительным введением в организм человека или животного непрямых аптикоагулянтов - группы препаратов, являющихся антагонистами витамина К. Непрямые антикоагулянты, как известно, нарушают синтез нормальной молекулы протромбина и факторов VII, IX, участвующих в плазменной коагуляции крови [Ferlund, Stenflo, 975].
В наших экспериментах применялся пелентан в дозе 10 мг/100 г массы (увеличенная в несколько раз терапевтическая доза) дважды в день в течение 2 сут. Исследовали изменения, наступающие в системе гемостаза после однократного введения отвара многокомпонентного препарата.
Предполагалось также оценить возможность влияния препарата на адгезивную функцию тромбоцитов, ингибированную ацетилсалициловой кислотой. Ацетилсалициловую кислоту вводили крысам перорально на протяжении 20 дней в дозе 150 мг/100 г массы животного. Адгезивную функцию кровяных пластинок исследовали, пропуская венозную кровь через фильтр, представляющий собой косичку из стекловолокнистой ткани [Одесская и др., 1971; Moolten, Vroman, 1949]. При этом количество тромбоцитов подсчитывалось способом фазово-контрастной микроскопии крови до и после пропускания ее через фильтр. Количество адгезированных кровяных пластинок выражалось в процентах.
Для более полного представления о функции сосудисто-тромбоцитарного гемостаза в условиях данного эксперимента исследовалась длительность кровотечения, а для характеристики общей свертывающей активности крови, сопряженной с функциональным состоянием кровяных пластинок, производилось исследование процесса свертывания нативной крови на коагулографе.
Заболевания печени сопровождаются нарушением процесса свертывания крови [Блюгер, Майоре, 1978; Kazraier et al., 1965]. Изучали изменение некоторых показателей системы гемокоагуляции у животных с экспериментальным гепатитом, который вызывали путем 4-кратного подкожного введения тетрахлорметана из расчета 0,25 мл/100 г массы в виде 50%-ного раствора на растительном масле. Контрольной группе животных вводили эквиобъемное количество стерильного растительного масла [Блюгер, Майоре, 1978]. Группа животных в опыте с первого дня затравки тетрахлорметаном перорально получала отвар тибетского препарата один раз в день в точение 7 сут.
В этой серии экспериментов представлялось необходимым исследовать активность фактора V [Owren, 1947], восстановление уровня которого является доказательством нормализации функциональной активности печени [Семенченко, 1973].
Статистическую обработку проводили по методам Вилкоксона - Манна - Уитни [Гублер, Генкин, 1973] и Монцевичюте-Эрингене [1964].
Фармакологическую активность лекарственной смеси "Тхаший-тханг" и ее компонентов, по-видимому, целесообразно выявлять по отношению к одному-двум звеньям системы гемостаза при помощи нескольких тестов. В связи с этим мы исследовали изменение времени свертывания крови, время рекальцификации плазмы, толерантность плазмы к гепарину, а также проницаемость сосудистой стенки (табл. 30). Отвары большинства компонентов лекарственной смеси проявили фармакологическую активность, сокращая время свертывания крови соответственно: горец птичий - на 25,9%, зубчатка поздняя - на 15,4, горечавка крупнолистная - па 16,2, оносма песчаная -на 31,4%. В эксперименте с раствором сухой свиной желчи нам не удалось выявить достоверных изменений времени свертывания крови. Отвар полной смеси сократил время свертывания крови на 58,2%.
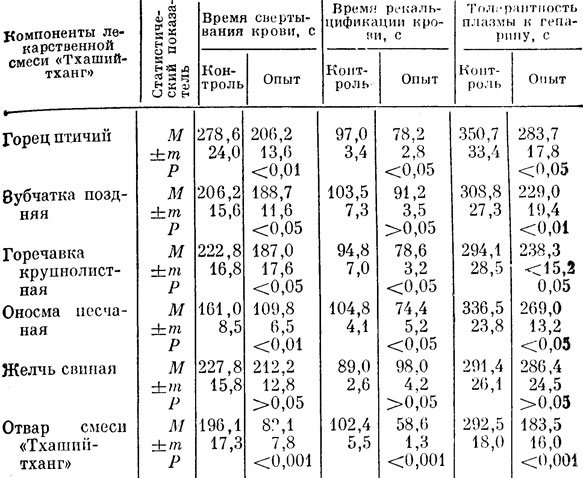
Таблица 30. Действие компонентов лекарственной смеси 'Тхаший-тханг' на гемокоагуляцию
В дальнейших экспериментах отвары всех компонентов лекарственной смеси, за исключением желчи, сокращали время рекальцификации плазмы соответственно на 18,8%; 8,0; 16,4; 28,5; 43,4%. Толерантность плазмы к гепарину повышалась под влиянием отваров: горца птичьего -- на 19,2%, горечавки крупнолистной - на 18,5, оносмы песчаной - на 20,0, желчи - на 1,6, зубчатки поздней - на 26,0 и полной смеси - па 37,2%.
Сравнение влияния отваров на изученные тесты ге-мокоагуляции показывает, что отвар полной смеси "Тхаший-тханг" оказывал более выраженное биологическое действие, чем отвар каждого компонента в отдельности.
Кровоточивость часто обусловливается патологическими изменениями, приводящими к нарушению проницаемости и резистентности сосудов. При субмикроскопическом исследовании структура кровеносных капилляров разных органов имеет ряд общих признаков. Стенка кровеносного капилляра состоит из трех слоев: эндотелиальных клеток, базальной мембраны и слоя периваскулярных клеток, окутанных аргирофильными и коллагеновыми волокнами и погруженных в аморфную часть основного вещества соединительной ткани [Movat, Fernando, 1963]. Ю. М. Шидаков и др. [1981] в экспериментах, выполненных в условиях высокогорья, отметили сопряженность между степенью проницаемости сосудистой стенки и свертывающей способностью крови.
Резистентность сосудистой стенки, или устойчивость ее к механическим воздействиям, в значительной степени лимитирует риск появления кровоточивости.
Существенное значение в поддержании нормальной резистентности сосудов имеют кровяные пластинки. При этом тромбоциты, внедряясь в эндотелиальные клетки, выделяют в них биологически активные вещества, в том числе факторы III и V, что нормализует функции стенки капилляра [Баркаган, 1980]. Трансфузия свежих тромбоцитов, взвешенных в плазме, прекращает спонтанные кровотечения [Ширяев, 1970]. Изложенное показывает, что проницаемость и резистентность сосудов, состояние сосудистого эндотелия прямо связаны с коагулологической активностью крови. В связи с этим мы исследовали фармакологическую активность отваров полной лекарственной смеси и ее компонентов на проницаемость сосудистой стенки.
Критерием степени проницаемости в наших экспериментах служило изображение разной степени проницаемости частиц туши в стенку микрососуда (рис. 9). У животных интактной группы после перорального введения физиологического раствора и внутривенной инъекции туши микроскопирование брыжейки не позволило выявить окрашенных микрососудов (рис. 11). У животных второй группы, которым вводили физиологический раствор, гистамин и тушь, сосудистая стенка интенсивно пропитывалась частицами туши, что соответствовало IV степени проницаемости (рис. 12).
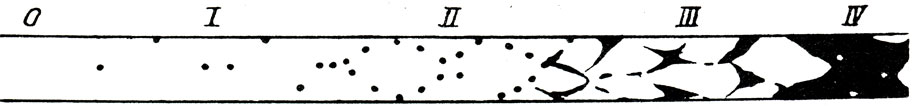
Рис. 9. Степени сосудистой проницаемости. Метки: I - диффузная точечная; II - структурированная точечная; III - пятнистая; IV - сливная пятнистая
Рис. 11. Проницаемость сосудов брыжейки при введении физиологического раствора и туши
Рис. 12. Проницаемость сосудов брыжейки при введении физиологического раствора, гистамина и туши
В группе животных, которым вводили отвар лекарственной смеси "Тхаший-тханг", сосудистая проницаемость также изменялась до IV степени (рис. 13).
Рис. 13. Изменение проницаемости при введении лекарственной смеси 'Тхаший-тханг' и туши
Исследование активности каждого компонента лекарственной смеси показало, что введение отвара горечавки крупнолистной вызывало проникновение частичек туши в сосуды брыжейки также как в случае введения отвара полной лекарственной смеси (рис. 14). Введение отваров зубчатки поздней, корня оносмы песчаной и раствора желчи не вызывало проникновения туши в морфологические структуры микрососудов, в связи с чем сосуды у животных в этих группах не отличаются от контроля (рис. 15-17).
Рис. 14. Изменение проницаемости при введении отвара горечавки крупнолистной и туши
Рис. 15. Изменение проницаемости при введении отвара зубчатки и туши
Рис. 16. Изменение проницаемости при введении оносмы песчаной и туши
Рис. 17. Проницаемость при введении раствора сухой желчи и туши
В группе животных, получавших отвар из травы горца птичьего, отмечалось очаговое проникновение частиц туши в стенки брыжеечных сосудов, что соответствовало II степени проницаемости (рис. 18).
Рис. 18. Проницаемость при введении отвара горца птичьего и туши
Таким образом, исследование биологической активности отвара полной лекарственной смеси "Тхаший-тханг" и ее компонентов выявило различное их действие на проницаемость сосудистой стенки. Отвары полной смеси, и отдельно горечавки крупнолистной, вызывали внедрение частиц тугаи в структуры сосудов брыжейки крыс, по интенсивности не уступающее действию гистамина. При этом необходимо подчеркнуть, что частицы туши, вводимые в кровоток животных, могли оседать в разных слоях стенки сосуда [Черных и др., 1975; Томилов и др., 1985].
Таким образом, отвары лекарственной смеси "Тхаший-тханг" и ее компонентов проявляли гемокоагулирующее действие, повышая общую свертывающую активность крови интактных животных. Вместе с тем они активно действовали на сосуды микроциркуляторного русла, что могло инициировать адгезию и динамические функции тромбоцитов.
В серии монографий, а также в многочисленных статьях представлен ряд звеньев регуляции нормального гемостаза, тромботических состояний и кровоточивости [Кузник, Скипетров, 1974; Кудряшов, 1975; Скипетров, 1978; Баркаган, 1980; Raby, 1974]. В этих и других работах [Акопов, 1981] большое значение придается проблемам регуляции функций системы гемостаза. Работа И. Э. Акопова [1981] посвящена поискам новых гемостатических средств резорбтивного действия. Автор справедливо выделяет возможность изыскания эффективных гемостатических препаратов из арсенала лекарственных растений.
Среди 17 групп лекарственных средств, насчитывающихся в классификации тибетской медицины [Вайдурья-онбо, гл. 20-21], выделены лекарства, влияющие на состояние органов кроветворения, и препараты, применяющиеся для остановки кровотечений [Базарон, Асеева, 1985]. Хотя общий гемостатический эффект препаратов отмечался еще в древности, до сих пор остается неясным механизм их действия.
В настоящем разделе представлены результаты изучения системы гемостаза у животных под влиянием однократного и курсового введения тибетского препарата. Использованные методы исследования характеризовали состояние плазменной коагуляции крови, а также позволяли судить об изменениях в сосудисто-тромбоцитарном звене гемостаза.
В исходной коагулограмме контрольной группы животных время рекальцифинации плазмы и ее толерантность к гепарину, характеризовавшие общую свертывающую активность крови, имели средние значение - 126 и 311 с (табл. 31). Среднее значение времени рекальцификации, характеризующее также активность плазменных прокоагулянтов, подтверждалось обычным уровнем активности фактора VIII (43,2 с). Физиологическое соотношение между указанными тестами характеризовало нормальный процесс тромбопластинообразования, что подтверждалось уровнем утилизации протромбина, показатель которого составлял 40,4 с. Протромбиновый индекс, отражающий процесс внешней активации коагуляции крови, не имел существенного отклонения от физиологического уровня и был равен 81,0%. Тромбиновое время составляло 17,4 с. Конечная стадия процесса свертывания крови в контрольной группе крыс характеризовалась активностью факторов XIII (38,3 с) и концентрацией фибриногена (3,47 г/л).
Однократное введение многокомпонентного тибетского препарата из сырья природного происхождения другой группе крыс вызывало значительное изменение процесса свертывания крови. Через 2 ч после введения отвара препарата время рекальцификации плазмы достоверно сократилось по сравнению с контролем, а толерантность плазмы к гепарину и активность фактора VIII, напротив, повысились (см. табл. 31). Протромбиновый индекс, характеризующий активность факторов протромбинового комплекса, повысился на 26,7%. Антикоагулянтная активность крови, о которой можно было судить по тесту утилизации протромбина, сохранялась на физиологическом уровне. Тромбиновое время составляло 14,5 с, в контроле - 17,4 с. Активность фактора XIII у крыс под влиянием препарата повышалась на 3,3 с, концентрация фибриногена существенно не увеличивалась.
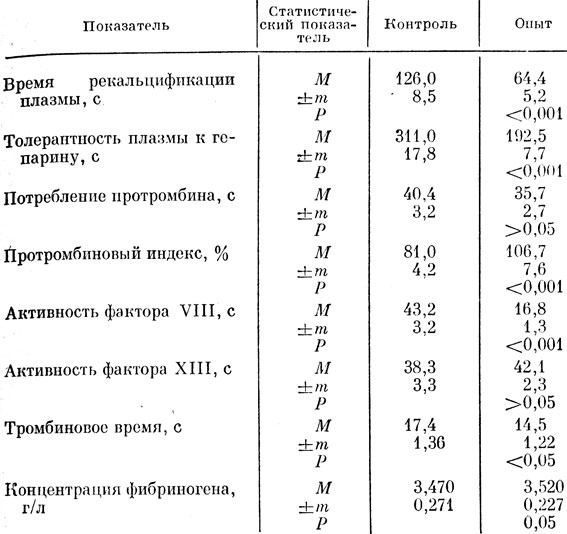
Таблица 31. Показатели свертывания крови у интактных крыс при однократном введении отвара 'Тхаший-тханг'
У крыс, однократно получавших отвар многокомпонентного препарата, количество тромбоцитов достоверно увеличилось, а длительность кровотечения и объем теряемой крови уменьшились по сравпению с контролем (табл. 32).

Таблица 32. Показатели сосудисто-тромбоцитарного гемостаза у интактных крыс при однократном введении отвара 'Тхаший-тханг'
Анализ электрокоагулограммы, дающий представление об интегральном процессе свертывания крови при участии форменных элементов и плазменных факторов коагуляции, показал, что время начала свертывания крови (показатель T1) у крыс, получавших отвар тибетского препарата, достоверно сокращалось по сравнению с контролем (табл. 33). Аналогичным образом изменялись показатели Т2 и Т. Иллюстрацией результатов эксперимента, представленных в табл. 33, являются рис. 19 и 20, на которых представлена запись электрокоагулограммы у крыс контрольной и подопытной групп.
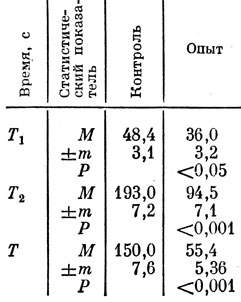
Таблица 33. Показатели электрокоагу-лограммы у интактных животных нод влиянием однократного введения отвара 'Тхаший-тханг'

Рис. 19. Коагулограмма крови после введения физиологического раствора за 2 ч до исследования
Представляло иптерес исследовать состояние свертывающей системы крови и количество тромбоцитов у животных при курсовом применении гемостатического препарата "Тхаший-тханг". Такая, постановка вопроса связана с принципом применения этого препарата в тибетской медицине, где его назначали курсом на 7-10 дней в дозе не более 1 г в сутки [БАЖ, л. 3-4]. В экспериментах данной серии использовали ту же дозу препарата, что и в опытах па животных при однократном его введении.

Рис. 20. Коагулограмма крови после введения отвара тибетского препарата за 2 ч до исследования
При курсовом введении отвар препарата вызывает состояние гиперкоагуляции, фиксируемое по большинству тестов (табл. 34). Причем сравнение результатов, полученных у животных при однократном применении препарата, с таковыми при курсовом его введении показало более выраженное стимулирующее воздействие на систему гемостаза во втором случае. Существенное различие отмечено по следующим тестам: толерантность плазмы к гепарину, протромбиновый индекс, активность фактора VIII и концентрация фибриногена. При этом возрастание свертывающего потенциала крови происходило на фоне физиологического уровня утилизации протромбина и практически не изменившегося тромбинового времени, что, вероятно, следует считать адаптивной реакцией организма, нивелирующей риск спонтанного тромбогенеза.
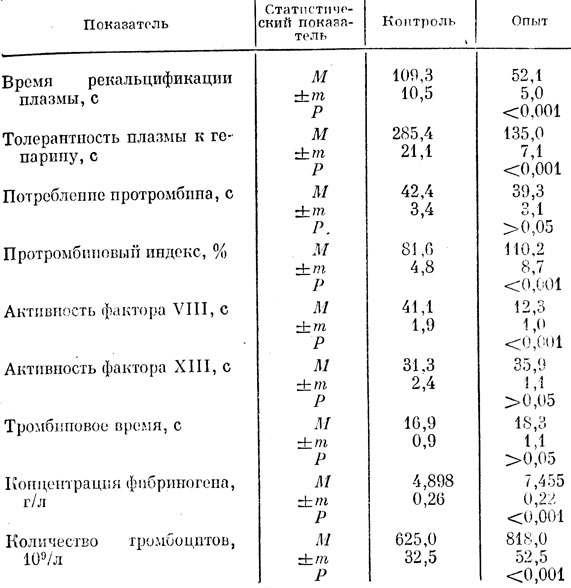
Таблица 34. Показатели свертывания крови у интактных крыс при курсовом введении отвара 'Тхаший-тханг'
Известно, что на одни и те же биологически активные вещества реакция животных разных видов неодинакова [Петков, 1974; Балуда и др., 1978]. Мы провели исследование изменений системы гемостаза у собак. Использовали ту же дозу препарата, с которой работали в экспериментах на крысах.
Курсовое введение препарата стимулировало систему гемостаза. Достоверно выраженная гиперкоагуляция, по сравнению с контролем, констатировалась по тестам: время рекальцификации плазмы и ее толерантность к гепарину (табл. 35). Гиперкоагуляция но этим тестам подтверждалась достоверным повышением активности фактора VII] и протромбинового индекса. Процесс гиперкоагуляции по данным тестам сопровождался пормальным уровнем утилизации протромбина, тромбинового времени и активности фактора XIII. Как и в предыдущем эксперименте, зафиксировано достоверное возрастание количества тромбоцитов по сравнению с аналогичным показателем в контрольной группе.
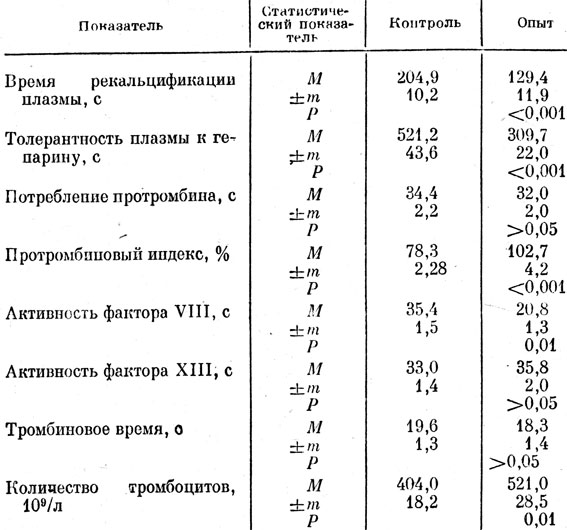
Таблица 35. Показатели гемостаза у собак после курсового введения отвара тибетского препарата
При сравнении стимулирующего действия препарата на общие коагуляционные тесты при длительном его применении у крыс и собак выяснилось, что более выраженное влияние препарат оказывает на систему свертывания крови крыс. Так, время рекальцификации плазмы у крыс сократилось на 52%, а у собак - на 37; толерантность плазмы к гепарину у крыс повышалась на 53, а у собак - на 41,5; протромбиновый индекс у крыс повышался до 110,2, а у собак - до 102,7%.
Таким образом, серия экспериментов, проведенных на крысах и собаках, показала, что действие препарата вызывает у животных гиперкоагуляцию крови, повышает функцию компонентов сосудисто-тромбоцитарного гемостаза, увеличивая при этом количество тромбоцитов, сокращая время кровотечения и объем теряемой крови.
В процессе изучения функций тромбоцитарно-сосудистого гемостаза, наступающих под влиянием однократного и длительного применения тибетского препарата, обнаружено, что во всех случаях увеличивается количество кровяных пластинок.
Продукция тромбоцитов в физиологических условиях осуществляется гигантскими клетками костного мозга - мегакариоцитами, которые отшнуровывают их от цитоплазмы. В свою очередь, процессы мегакариоцитопоэза и тромбоцитопоэза, осуществляемые кроветворной тканью, тесно связаны между собой и регулируются холинореактивными системами [Мосягина и др., 1976; Денисенко, 1980; Kimura, 1986].
Известно, что введение в организм животного мелкого стекла, скипидара, яичного белка и некоторых других веществ вызывает реактивный тромбоцитоз [Баранов, 1966]. Наряду с этим показано, что стимуляция функциональной активности мегакариоцитарно-тромбоцитарного аппарата в физиологических и экстремальных условиях осуществляется тромбоцитоноэтинами [Кассирский, Алексеев, 1970; Mizoguchi, Nomura, 1986]. Учитывая это, для выяснения возможного механизма тромбоцитоза, возникающего у животных под влиянием тибетского гемостатического препарата, изучали тромбоцитопоэтическую активность сыворотки крови крыс, получавших отвар тибетского препарата в течение 5 дней. В контрольных сериях изучена динамика количества тромбоцитов у крыс после введения физиологического раствора и сыворотки от интактных животных (табл. 36). Полученные данные показали, что инъекция физиологического раствора и сыворотки крови от интактных животных-доноров не изменяет числа тромбоцитов в периферической крови крыс-реципиентов через 1,3 и 6 сут от начала эксперимента. В то же время введение сыворотки от крыс, получавших отвар тибетского препарата, привело к значительному увеличению количества тромбоцитов у животных-реципиентов. При этом существенное увеличение числа кровяных пластинок на 94,3 · 109/л зарегистрировано уже через сутки после введения сыворотки. Известно, что накопление тромбоцитов в мегакариоцитах происходит постепенно, тогда как отторгаются они от цитоплазмы этих клеток путем "взрыва" [Пиксанов, 1969]. Очевидно, что у животных, получавших препарат, ускоряется процесс накопления и отторжения кровяпых пластинок. Это положение не противоречит данным других исследователей, так как многие гемостатические препараты из растений увеличивают количество тромбоцитов [Алиев, 1960; Акопов, 1981]. Через 3 и 6 сут тромбоцитоз продолжал нарастать: количество пластинок увеличивалось соответственно на 222,4 и 238,1 · 109/л.
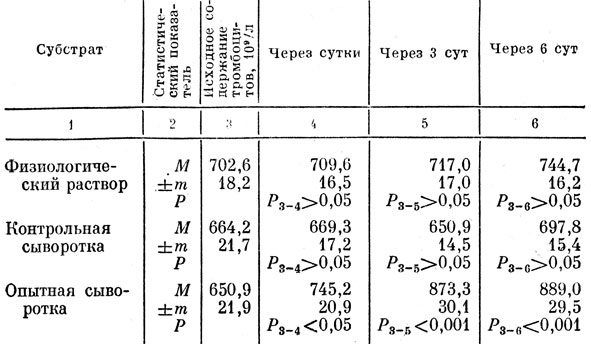
Таблица 36. Динамика тромбоцитов у крыс-реципиентов сыворотки крови от крыс-доноров, предварительно получавших отвар препарата 'Тхаший-тханг'
В костном мозге крыс, получавших физиологический раствор (контроль 1), количество мегакариоцитобластов составляло 1,0%, базофильных мегакариоцитов насчитывалось 6,4, полихроматофильных мегакариоцитов - 69,6, оксифильных форм - 16,0, голоядерных - 4,2 и дегенеративных мегакариоцитов - 3,8% (табл. 37).

Таблица 37. Клеточный состав мегапариоцитограммы (%) у крыс-реципиентов, получавших инъекции физиологического раствора, сыворотки интактных и подопытных животных
В то же время у животных-реципиентов, получавших сыворотку крови интактных животных (контроль 2), существенных изменений в мегакариоцитограмме по сравнению с контролем не произошло.
Сравнение мегакариоцитограмм и функциональной активности мегакариоцитов показало, что иод влиянием сыворотки крыс-доноров у крыс-реципиентов (опыт) по сравнению с контролем 2 количество мегакариоцитобластов и базофильных мегакариоцитов увеличилось на 50 и 40% соответственно, показатели полнхроматофильных и оксифильных форм мало отличались от показателей группы контроля и составляли 76 и 12%. Число голо-ядерных и дегенеративных форм значительно уменьшилось по сравнению с таковым крыс первой и второй контрольных групп и было равно соответственно 1,4 и 1,0%. Существенная разница выявлена в количестве шнурующих тромбоциты мегакариоцитов, показатель которых в этой группе крыс достигал 54%.
Следовательно, увеличение в костном мозге тромбоцитоотделяющих клеток мегакариоцитарного ряда и появление периферического тромбоцитоза обусловлены введением тромбоцитопоэтически активной сыворотки крови крыс-доноров.
Таким образом, в данной серии экспериментов изучены изменения системы гемостаза у здоровых животных в процессе применения многокомпонентной смеси из лекарственного сырья природного происхождения. Результаты экспериментов показали, что отвар многокомпонентной лекарственной смеси повышал общую свертывающую активность крови, которая характеризовалась ускорением времени рекальцификации плазмы, повышением толерантности плазмы к гепарину и протромбинового индекса. При этом у животных через 2 ч после введения отвара повышалась активность фактора VIII. Гиперкоагуляция цельной крови зарегистрирована на электрокоагулограмме по показателям T1, Т2 и Т.
Вместе с тем доказано, что под влиянием отвара лекарственной смеси значительно повышались функции сосудисто-тромбоцитарного гемостаза. Увеличивалось количество тромбоцитов, сокращалось время кровотечения и при этом снижался объем теряемой крови. Показано, что возникающий тромбоцитоз периферической крови обусловлен тромбоцитопоэтической активностью сыворотки крови крыс-доноров, получавших отвар многокомпонентной лекарственной смеси.
При длительном введении отвара многокомпонентной смеси "Тхаший-тханг" состояние гиперкоагуляции усиливалось, судя по показателям общекоагуляционных тестов и нарастанию концентрации фибриногена. Отвар многокомпонентной смеси "Тхаший-тханг" вызывал гиперкоагуляцию крови и повышал функции сосудисто-тромбоцитарного звена гемостаза у разных видов животных.
Для сравнения влияния отвара изучаемого препарата на скорость свертывания крови и других препаратов, применяемых в практической медицине, мы выбрали 5%-ный настой травы лагохилуса опьяняющего и 1,0%-ный раствор хлорида кальция. Результаты эксперимента показали, что отвар препарата "Тхаший-тханг" ускоряет время свертывания оксалатной плазмы в среднем на 54,4% по сравнению с 1%-ным раствором хлорида кальция, тогда как 5%-ный настой травы лагохилуса опьяняющего - лишь на 22,7%.
Антикоагулянтная терапия в клинической практике занимает значительное место. Антикоагулянты непрямого действия могут быть разделены на четыре подгруппы: монокумарины, дикумарины, циклокумарины, производные индандиона. Являясь антагонистами витамина К, антикоагулянты непрямого действия, введенные в организм, приводят к нарушению синтеза протромбина, факторов протромбинового комплекса и появлению аномальных белков, что затрагивает концевую часть полипептидной цепи, где находятся Са-связывающие участки, играющие большую роль в активации протромбина. Оказалось, что витамин К принимает участие в карбоксилировании глутаминовой кислоты; из-за отсутствия или блокирования карбоксилирования этого остатка дефектная молекула протромбина теряет способность связывать кальций, что исключает его участие в свертывании крови [Kazmier el al., 1965; Stenflo, Ferlund, 1974].
Действие непрямых антикоагулянтов на систему гемостаза не ограничивается снижением синтеза факторов протромбинового комплекса, их введение приводит к нарушению резистентности и проницаемости сосудистой стенки. Получены данные о нарушении адгезивной функции тромбоцитов [Mikita et al., 1986].
Вместе с тем следует иметь в виду, что широкое применение антикоагулянтов в ряде случаев сопряжено с передозировкой препаратов, что увеличивает риск развития геморрагических осложнений [Лужников, Фирсов, 1968].
Мы исследовали влияние препарата на систему гемостаза животных с плазменной гипокоагуляцией, возникшей после введения непрямого антикоагулянта пелептаиа (10 мг/100 г, дважды в день, в течение 2 сут). Одновременно исследовали показатели плазменной коагуляции и количество кровяных пластинок.
Коагулограмма животных, составлявших группу дополнительного контроля (контроль 1), характеризовалась физиологическими уровнями показателей. Время рекальцификации плазмы и толерантность плазмы к гепарину соответственно были равны 89,7 и 355,8 с (табл. 38). Протромбиновый индекс был равен 85,7%. При этом показатель потребления протромбина, активность факторов VIII и XIII составляли соответственно 39,0 28 и 33,3 с. Показатель тромбинового времени был равен 17,8 с. Количество кровяных пластинок составляло 629,0 · 109/л.
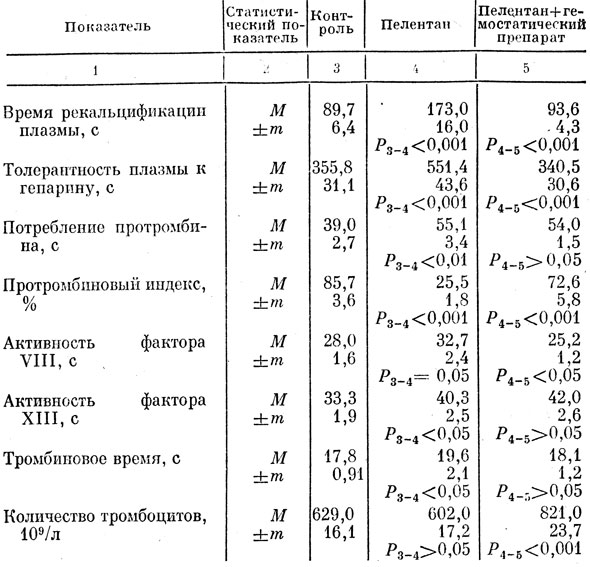
Таблица 38. Влияние отвара гемостатического препарата на показатели системы гемостаза у крыс с гипокоагуляцией после введения пелентана
Показатели коагулограммы животных, получивших пелентан (контроль 2), значительно отличались от показателей крыс вышеописанной группы. Общая свертывающая активность крови снизилась, о чем свидетельствовало увеличение времени рекальцификации плазмы до 173 с и снижение толерантности плазмы к гепарину до 551,4 с. Активизировался процесс утилизации протромбина, па что указывало увеличение времени этого показателя до 55,1 с. Протромбиновый индекс при этом снизился до 25,5%. Снижение активности процесса плазменной коагуляции подтвердилось снижением активности фактора VIII, значение которого составляло 32,7 с. Активность фактора XIII была повышенной и составляла 40,3 с, тогда как у интактных животных - 35,3 с. Повышение активности фактора XIII объясняется тем, что под влиянием антикоагулянта этот фактор высвобождается из комплекса, в котором он находился с фибриногеном [Бронштейн, 1967]. Тромбиновая активность в этой группе крыс достоверно снижалась. Количество тромбоцитов соответствовало физиологическому уровню и составляло 602 · 109/л.
У крыс, получавших пелентан и однократно отвар тибетского препарата, показатель времени рекальцификации сокращался по сравнению с контролем 2 до 93,6 с, одновременно с этим повышалась толерантность плазмы к гепарину. Процесс потребления протромбина в обеих группах сохранялся на высоком уровне и был интенсивнее по сравнению с группой контроля соответственно на 16,1 и 15,0 с. Под влиянием препарата протромбиновый индекс повышался на 47,1%, активность фактора VIII возрастала на 7,5 с, фактора XIII - на 1,9 с, тромбиновое время сокращалось на 1,5 с, количество тромбоцитов увеличивалось до 821,0 · 109/л.
Представленные результаты экспериментов показали, что однократное применение отвара многокомпонентного препарата из сырья природного происхождения нормализует общую коагуляционную способность и повышает антикоагулянтную активность крови, на что указывает сокращение тромбинового времени. Вместе с тем повышается активность плазменного фактора VIII. Активность антигемофильного глобулина в этом случае могла повыситься под влиянием препарата, поскольку такое действие его было доказано на интактных крысах. Повышение активности фактора XIII, вероятнее всего, происходит под влиянием тромбоцитов, количество которых увеличивалось у данной группы животных. Зависимость активности фактора XIII от количества кровяных пластинок показана исследованиями В. П. Балуды [1981]. Повышение тромбинового индекса у крыс, получавших отвар тибетского препарата, позволяет говорить о его способности повышать протромбиновую активность кропи при пелентановой гипокоагуляции.
Повышенная утилизация протромбина у животных, получавших отвар многокомпонентного препарата, и равное этому показателю потребление протромбина у крыс, получавших пелентан, должны рассматриваться как компенсаторная мера организма, находящегося в экстремальных условиях.
В предыдущих опытах выявлена гемостатическая активность отвара тибетского препарата по отношению к микроциркуляторному звену гемостаза. Известно, что динамические функции тромбоцитов и реакция освобождения из них биологически активных соединений являются основой механизма первичной остановки кровотечения, поддержания резистентности сосудистой стенки, осуществления функционального взаимодействия между клеточным, плазменным и сосудистым компонентами гемостаза.
Успехом в исследовании сосудистого гемостаза явилось установление роли простогландинов и циклических нуклеотидов в функциональной активности и реакции освобождения кровяных пластинок [Федоров, 1979; Кubisz, 1975; Fenichel et al., 1975].
Предшественником синтеза простогландинов в тромбоцитах и других клетках организма является арахидоновая кислота. Под воздействием фермента циклооксигеназы эта кислота превращается в циклические эндоперекиси. Арахидоновая кислота и циклические эндоперекиси обладают способностью агрегировать тромбоциты. К числу тромбоцитоагрегирующих агентов относятся простогландины Е2 и F2a. Из продуктов метаболизма арахидоновой кислоты наибольшим агрегирующим действием обладает тромбоксан А2 [Hamberg et al., 1975]. В дальнейшем было показано, что синтез простогландинов активно протекает в процессе свертывания крови, а также в плазме, богатой тромбоцитами [Silver, Smith, 1972], и при агрегации кровяных пластинок, вызванной коллагеном, АДФ и другими индукторами агрегации. Отмечается корреляция между влиянием простогландинов на агрегационную функцию и аденилатциклазу кровяных пластинок [Silver, Smith, 1972]. В регуляции процесса агрегации и реакции освобождения тромбоцитов и взаимодействия их с сосудистой стенкой большое значение имеет простогландин, синтезируемый микросомальной фракцией эндотелиальных клеток - простациклин. Простациклин ингибирует процесс агрегации кровяных пластинок, а также оказывает вазодилятирующее и гипотензивное действие [Vergaftig, Daz-Hai, 1973].
Наряду с этим динамические функции тромбоцитов подавляются многими лекарственными средствами. Из известных в настоящее время ингибиторов агрегации кровяных пластинок следует назвать ацетилсалициловую кислоту, салициловый натрий, аминазин, хлорохин и др. Ингибирующее действие ацетилсалициловой кислоты на динамические функции тромбоцитов основано на блокировании активности фермента циклооксигеназы, участвующей в синтезе простогландинов [Anggard, Sammuelsson, 1965].
Для снижения функциональной активности кровяных пластинок в наших опытах мы применяли ацетилсалициловую кислоту, которая является наиболее изученным ингибитором процесса адгезии и агрегации [Ажгихин, 1978; Балуда и др., 1983; Smith, Willis, 1971; Silver, Smith, 1972]. Ацетилсалициловая кислота значительно, увеличивает время кровотечения. В реализации действия этого препарата па микроциркуляторный гемостаз значительную роль играет ее ацетильная группа. Эффект применения ацетилсалициловой кислоты зависит от дозы. При курсовом ее назначении показатели тромбоцитарно-сосудистого гемостаза снижаются и расстраиваются значительно сильнее, чем при однократном применении. Действие ацетилсалициловой кислоты проявляется в нарушении взаимодействия (контакта) тромбоцитов с соединительной тканью (коллагеном) и подавлении АДФ-агрегации. При этом кислота блокирует освобождение АДФ, серотонина и других тромбоцитарных факторов [Баркага и и др., 1971].
Наши исследования показали, что у интактных крыс длительность кровотечения, по средним данным, составляла 167,1 с, исходное количество тромбоцитов было равно 516,5 · 109/л. После пропускания крови через фильтр количество кровяных пластинок уменьшилось на 16,6% (табл. 39).

Таблица 39. Показатели тромбоцитарно-сосудистого гемостаза у крыс при однократном введении ацетилсалициловой кислоты и отвара тибетского препарата
У животных, получавших ацетилсалициловую кислоту и физиологический раствор, длительность кровотечения составляла 237, 1 с и была на 64 с больше, чем у крыс интактной группы. Количество кровяных пластинок в этой группе было равно 575,2 · 109/л. После пропускания крови через фильтр количество адгезированных тромбоцитов составило 2,6%.
Анализ показателей у животных, которые через 2 ч после введения ацетилсалициловой кислоты получили отвар многокомпонентного препарата, выявил, что у крыс этой группы снижалась степень гипофункции сосудисто-тромбоцитарного гемостаза. Длительность кровотечения сократилась на 53,8 с по сравнению со средними данными группы крыс, получавших ацетилсалициловую кислоту и физиологический раствор. Количество адгезированных пластинок равнялось 37,7%, тогда как у крыс, получавших ацетилсалициловую кислоту и физиологический раствор, адгезировалось лишь 2,6% тромбоцитов.
В группе животных, получавших ацетилсалициловую кислоту и физиологический раствор, показатели электрокоагулограммы изменились в сторону гипокоагуляции (табл. 40). Очевидно, что действие ацетилсалициловой кислоты привело к достоверному увеличению времени тромбопластинообразования, общего времени свертывания и замедлению процесса образования фибрина. Данные процессы, как известно, зависимы от активности тромбоцитарного фактора III, освобождение которого ингибируется под влиянием ацетилсалициловой кислоты.
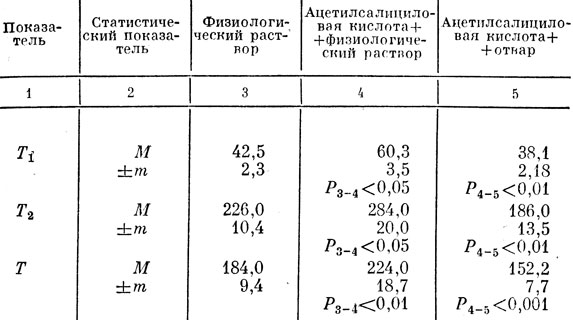
Таблица 40. Показатели электрокоагулограммы цельной крови у крыс под влиянием ацетилсалициловой кислоты и отвара тибетского препарата
У крыс, получавших ацетилсалициловую кислоту и отвар многокомпонентного препарата, все показатели по сравнению с показателями животных, получавших ацетилсалициловую кислоту с физиологическим раствором, оказались достоверно измененными в сторону гиперкоагуляции (см. табл. 40).
Результаты, полученные на данном этапе исследований, показали, что нарушения, вызываемые ацетилсалициловой кислотой в системе гемостаза, в значительной мере устраняются однократным применением многокомпонентного препарата.
Установлено, что многие факторы системы свертывания крови (I, II, V, VII-X) синтезируются в печени [Kazmier et al., 1965]. Печень является главным депо витамипа К, необходимого для синтеза II, VII, IX и X факторов протромбинового комплекса. Но современным представлениям, дефицит витамина К приводит к синтезу дефектной молекулы протромбина, которая становится не способной связываться с фосфолипидами через кальциевый мостик [Stenflo et al., 1974]. Витамин К играет важную биологическую роль как кофермент, участвующий в реакции кокарбоксилирования глутаминовой кислоты в белках прокоагулянтов с образованием в их молекулах кальцийсвязывающих центров [Ferhmd, Stenflo, 1975]. По имеющимся сведениям, печень принимает активное участие в метаболизме фибриногена и регулировании жидкого состояния крови. Показано, что около 70% фибриногена подвергается распаду и лишь 30% его участвует в физиологическом гемостазе [Давыдов, 1977]. Предполагается возможность распада фибриногена, минуя стадию образования фибрина. Имеются данные, свидетельствующие о важной роли клеток Купфера в процессах внутриклеточного фибринолитического распада I фактора [Давыдов, 1977].
Нарушение функционального состояния печени, возникающее от многих причин, существенным образом сказывается на состоянии системы гемостаза. В частности, под влиянием тетрахлорметана в печени наблюдается первичное поражение эндоплазматической сети (ЭС) гепатоцитов, вслед за которыми в патологический процесс вовлекаются другие органеллы клеток [Блюгер, Майоре, 1978]. Из эстеразной системы наиболее чувствительным ферментом оказалась глюкозо-6-фосфатдегидрогеназа, которая инактивируется в первую очередь [Фрупдер, 1968]. Такое действие тетрахлорметана связано с тем, что в процессе биотрансформации он образует свободные радикалы (ССl4 → ССl-3 + Сl), которые активно влияют на метаболизм клетки, непосредственно действуя на функциональные группы белков и ферментов [Арчаков, 1975; Darmoni et al., 1986]. Поскольку факторы свертывания крови - вещества белковой природы, то именно нарушение белкового обмена под действием тетрахлорметана является причиной снижения синтеза и нарушения физиологического уровня прокоагулянтов [Давыдов, 1977].
В настоящей серии экспериментов мы использовали модель токсического гепатита для изучения изменений системы гемостаза, наступавших под влиянием отвара многокомпонентного препарата из сырья природного происхождения. С этой целью животным подкожно четырехкратно вводили по 0,25 мл тетрахлорметана. Это доза, согласно данным К. А. Мещерской [1954], А. Ф. Блюгера, А. Я. Майоре [1978], вызывает токсический гепатит о типичными морфофункциональными проявлениями. Отвар многокомпонентного препарата вводили группе животных с первого дня затравки и продолжали в течение 7 сут. Для характеристики состояния плазменной коагуляции использованы общепринятые методы исследования системы гемостаза (табл. 41).
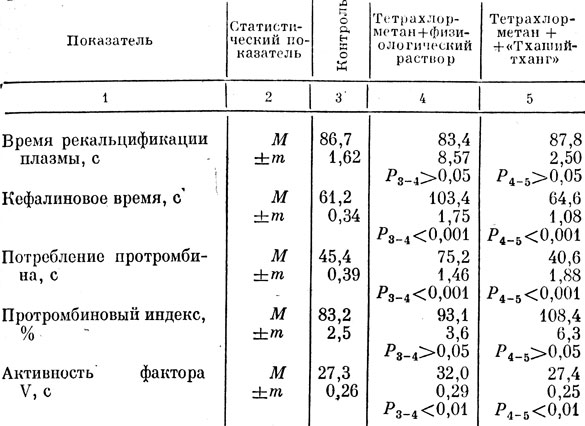
Таблица 41. Показатели системы гемостаза под влиянием отвара 'Тхаший-тханг' у крыс с экспериментальным гепатитом
У животных с токсическим гепатитом, перорально получивших физиологический раствор, отмечалась достоверная депрессия активности факторов гемостаза. Исключение составили время рекальцификации плазмы и протромбиновый индекс, которые лишь незначительно отличались от соответствующих показателей крыс контрольной группы.
В группе животных с токсическим гепатитом, которым с лечебно-профилактической целью вводили отвар тибетского гемостатического препарата, рассматриваемые показатели гемостаза претерпевали отчетливые позитивные сдвиги по сравнению с нелеченным контролем. Так, кефалиновое время потребления протромбина и активность фактора V не только были достоверно ниже, чем у крыс с токсическим гепатитом, но и мало отличались от уровня аналогичных показателей интактных животных. Исключение, как и в предыдущем случае (контроль 2), составили время рекальцификации плазмы и протромбиновый индекс. Первый из названных показателей существенно не отличался от уровня соответствующего параметра как у интактных животных, так и у крыс с токсическим гепатитом. Протромбиновый индекс, хотя и повышался в группе крыс с гепатитом, но уровня статистической значимости это различие не достигло.
Воспалительные процессы в печени, интоксикации гепатотропными ядами нередко осложняются возникновением синдрома диссеминированного внутрисосудистого свертывания крови (ДВС). Возникший синдром ДВС во многих случаях не достигает полного развития, что существенно затрудняет его распознавание [Баркаган, 1980]. Нарушения системы гемокоагуляции при гепатите мы рассматриваем как последствия повреждения систем, синтезирующих факторы свертывания крови патологически измененной печенью и как итог усиленного потребления их в процессе ДВС.
Об этом свидетельствуют результаты исследования гемостаза, полученные у животных с токсическим гепатитом (контроль 2), которые выражались: в сокращении времени рекальцификации плазмы на 3 с, повышении процесса утилизации протромбина на 29,6 с, повышении протромбинового индекса на 9,9%. Эта комбинация отклонений в системе гемостаза, хотя и выраженная в минимальной степени, характеризует первую фазу ДВС, когда отмечается повышение свертывающего потенциала крови. Увеличение кефалинового времени на 42,2 с и снижение фактора V на 4,7 с указывают на формирование второго периода синдрома ДВС - коагулопатии потребления [Кузник, Патеюк, 1981].
Таким образом, под влиянием курсового введения отвара многокомпонентного препарата из сырья природного происхождения у животных с токсическим гепатитом нормализовался процесс плазменной коагуляции и купировались проявления ДВС синдрома. В частности, восстановление активности фактора V плазмы - маркера функционального состояния печени [Семенченко, 1973] - свидетельствует о выраженном гепатотропном фармакотерапевтическом действии отвара "Тхаший-тхаиг". Высокий уровень протромбинового индекса, свидетельствующий об активности факторов протромбинового комплекса, мог быть следствием остаточных явлений процессов цитодеструкции гепатоцитов, липопротеидные комплексы биомембран которых при попадании в кровоток способны нарушать функции тромбопластических веществ [Давыдов, 1977; Зубаиров, 1978].
Подводя итоги результатам проведенных исследований, следует вкратце остановиться на некоторых ключевых, на наш взгляд, теоретических положениях и собственных экспериментальных данных, без которых трудно представить себе механизм фармакологического действия тибетского гемостатического препарата "Тхаший-тханг".
Длительные и глубокие исследования фармакологических свойств и терапевтической активности препаратов из растений, к сожалению, не способствовали раскрытию механизмов коагулирующего действия большинства гемостатических средств. Вместе с тем следует полагать, что формирование гемостатического потенциала основано на общности точек фармакологического приложения биологически активных веществ в центральной нервной системе. Одним из таких регулирующих центров, вероятно, является гипоталамус.
Другие представления о механизме стимулирующего гемостаз действия лекарственных веществ указывают на участие в этом процессе сосудистой стенки. Расширяя сосудистую стенку, биологически активные вещества (например, содержащиеся в растениях) способствуют выбросу из нее тромбопластических веществ и делают более доступным подэндотелиальный адвентиций, что способствует активизации процесса гемокоагуляции [Кузник, 1979].
На процессы свертывания крови существенное влияние оказывает вегетативная нервная система, регулируя перераспределение крови в сосудистых регионах, синтез про- и антикоагулянтов, изменяя свойства контактирующих поверхностей [Зубаиров, 1978].
Действие фармакологически активных веществ, в нашем случае химических компонентов отваров растений, на процессы свертывания крови находится в зависимости от множества факторов: пути введения лекарственного вещества, количества свободных рецепторов для него, водо- и жирорастворимости, поверхностного напряжения, а также формы примененного вещества.
По существующей традиции в Тибете, Бирме, Китае и других странах Юго-Восточной Азии многие лекарства применяются в виде отвара. И в настоящее время эта форма может с успехом использоваться в медицинской практике [Тенцова, Ажгихин, 1971]. Поэтому исследуемый препарат мы применяли только в виде отвара, так как при изменении рекомендуемой лекарственной формы могло измениться свойственное для него действие.
Эксперименты, выполненные для определения биологической активности отвара каждого компонента и полной лекарственной смеси по отношению к системе гемостаза и сосудистой стенке, выявили фармакологический вклад каждого ингредиента и синергическое действие компонентов изученной лекарственной смеси.
Исследования, проведенные на интактных крысах, показали, что препарат оказывает стимулирующее действие на плазменно-коагуляционное звено системы гемостаза. Вместе с тем установлено стимулирующее действие препарата на сосудисто-тромбоцитарное звено коагуляции интактных крыс.
В следующей серии опытов на крысах и собаках препарат вводили в течение 7 с. В этих условиях как у крыс, так и у собак зарегистрировано стимулирующее влияние препарата на плазменную коагуляцию и увеличение числа кровяных пластинок. Действие препарата на некоторые показатели коагулограммы при длительном применении оказалось сильнее, чем при однократном его введении.
Одной из основных особенностей большинства препаратов традиционной медицины восточных стран, в том числе и Тибета, является их многокомпонентность. Очевидно, что основой эффекта комбинированных препаратов является принцип синергического и потенцированного действия химических веществ отдельных компонентов. Это положение подтверждается многочисленными литературными источниками [Алиев, 1960; Гриневич, Брехман, 1970а, б; Ковалева, 1971; Муравьев и др., 1978; Loewe, Muiscer, 1927; Stern, 1971]. В то же время есть сведения о том, что применение комбинированных препаратов может не только усилить действие, но и ослабить его [Ariens, 1969].
Известно, что любой патологический процесс нарушает гомеостаз, координацию взаимодействий между органами и функциональными системами. В этих условиях, помимо внутри- и околососудистого свертывания, коагуляционный процесс происходит в серозных полостях и некоторых тканевых жидкостях. Участие многих факторов гемокоагуляции в поддержании гемостаза происходит одновременно с вовлечением их в другие виды обмена веществ [Зубаиров, 1978]. Следовательно, это взаимодействие факторов свертывания крови необходимо корригировать фармакологическими средствами. В первую очередь коррекции должны подвергаться функции органов, принимающих прямое участие в формировании гемостатического потенциала.
Поражения печени являются частой причиной нарушений в системе свертывания крови, которые могут протекать со значительной кровоточивостью. В связи с этим возникла необходимость изучить возможность использования препарата для нормализации свертывания крови у животных с острым токсическим гепатитом.
Как было сказано выше, первичным местом действия тетрахлорметана является эндоплазматическая сеть гепатоцитов. Уже в первые часы после введения гепатотропного яда в эндоплазматической сети происходят процессы вакуолизации эргастоплазмы, снижается активность многих маркерных микросомальных ферментов, в частности, глюкозо-6-фосфатазы и др. [Фрундер, 1968; Арчаков, 1975]. Вслед за эндоплазматической сетью действие ССl4 распространяется на митохондрии, что проявляется нарушением метаболизма в этих органеллах уже через 6 ч после начала действия тетрахлорметана [Арчаков, 1975; Покровский, 1979]. Дальнейшее действие яда вызывает дегенеративные процессы в клетках, которые проявляются выходом из органелл белков, фосфолипидов и РНК [Фрундер, 1968]. Описанные явления обусловлены аутолитическим действием лизосомальных фермептов, активация которых фиксируется через 6-8 ч после введении в организм тетрахлорметана [Блюгер, Майоре, 1978]. Лабилизация лизосом происходит с разрывом окружающей их мембраны. Гепатотоксическое действие тетрахлорметана приводит к смешанным дистрофически-некротическим изменениям в печени. Вполне естественно, что возникшие и развившиеся функциональные и морфологические изменения в ткани органа не могут не отражаться на уровне и активности факторов, участвующих в гемостазе, поскольку большинство из них представлены белками, синтезируемыми в печени [Маркосян, 1966; Кудряшов, 1975].
Под действием тетрахлорметана происходят изменения белоксинтезирующей системы печеночных клеток [Блюгер, Майоре, 1978]. В связи с этим мы вправе прогнозировать при введении тетрахлорметана нарушения или отклонения от нормы процесса гемостаза [Цинкаловский, 1960; Давыдов, 1977; Kazmier et al., 1965]. В этой ситуации гепатонротекторное действие изучаемого препарата могло проявиться защитной ролью по отношению к гемостатическим функциям печеночных клеток.
Проведенные нами опыты по моделированию острого токсического гепатита полностью подтвердили это предположение. Нарушение гемостаза, по нашему мнению, происходило в результате появления в кровяном русле продуктов распада клеток, ферментов и других субстратов, активизирующих и меняющих активность и соотношение факторов, ответственных за процесс свертывания крови. Эксперименты с одновременным введением крысам тетрахлорметана и отвара "Тхаший-тханг" показали его нормализующее действие на состояние гемостатической функции печени. Полученные результаты позволяют утверждать, что примененный в опытах препарат у крыс с гепатитом, вызванным тетрахлорметаном, поддерживает гемостатическую функцию печени. Этот факт можно объяснить следующим.
Патологические изменения, развивающиеся в печени, в основном являются следствием патологического процесса свободнорадикального окисления [Арчаков, 1975]. Вместе с тем установлено, что наиболее эффективными ингибиторами свободнорадикального окисления являются фенольные соединения [Эмануэль, 1963]. Стал известен механизм действия фенольных соединений в реакциях свободнорадикального окисления, который сводится к обрыву цепи за счет реакции фенольных молекул с радикалами R и RO2, ведущими цепь окисления [Эмануэль, 1968]. Положительное действие отвара многокомпонентного препарата в случае применения его на фоне действия тетрахлорметана, вероятно, объясняется тем, что флавоноидные соединения, а также, вероятно, и другие химические вещества, имеющиеся в научаемом препарате, препятствуют действию вводимого гепатотропного яда и способствуют процессам регенерации в печени.
Экспериментальные и клинические результаты других исследований [Казанцев, 1970; Эмануэль, 1968; Hansteen, 1980] говорят о том, что фенольные компоненты препаратов способны предотвращать процессы некроза клеток печени и ускорять синтез белка, а также нормализовать свертывающий потенциал крови [Мищенко, 1981].
Основываясь на существующей современной концепции о гомеостазе [Балуда, 1981; Spaet, 1966], мы полагаем, что комплекс биологически активных веществ, содержащихся во всех компонентах примененного препарата, является активной комбинацией флавоноидов, дубильных веществ, алкалоидов, витаминов и других ингредиентов, влияющих на звенья гемостаза различным образом и способствующих нормализации процессов гемокоагуляции. Особенно важным в данном случае нам представляется наличие в растительных компонентах препарата флавоноидов, противовоспалительное действие которых [Хаджай, 1970] могло сыграть большую роль в нормализации гемостатической функции печени.
Таким образом, препарат, состоящий из пяти компонентов в форме отвара, в значительной степени снимает патологическое действие тетрахлорметана, нормализует функцию свертывающей системы и повышает протромбиновую активность крови.
Синтез факторов протромбинового комплекса, осуществляемый печенью в присутствии витамина К, играет немаловажную роль в осуществлении физиологического процесса гемостаза. Однако клиническая практика показывает, что многие патологические процессы, сопровождающиеся дефицитом витамина К, а также широкое применение в медицине препаратов - антагонистов витамина К приводят к развитию геморрагических состояний. Поэтому принципиально важным является изучение практических способов профилактики и лечения вышеупомянутых синдромов.
В экспериментах показано, что специфическое действие непрямых антикоагулянтов заключается в нарушении биосинтеза нормальной молекулы протромбина, что, в свою очередь, приводит к нарушению дальнейших процессов его активации и образованию плазменных факторов свертывания II, VII, IX, X [Бронштейн, 1970; Stenflo et al., 1974; Ferlund, Stenflo, 1975]. Вместе с тем действие антикоагулянтов не ограничивается блокадой синтеза плазменных факторов свертывания, а распространяется и на микроциркуляторные звенья гемостаза. При этом нарушается адгезивная активность кровяных пластинок, снижается активность тромбоцитарных факторов II и IV, изменяется морфологическая структура тромбоцитов и теряется их способность к агрегации, изменяется состав тромбоцитограммы, в которой увеличивается число микроформ и значительно уменьшается число средних по величине тромбоцитов. Вместе с изменениями кровяных пластинок под влиянием действия непрямых антикоагулянтов формируются морфологические изменения в структуре стенок сосудов, которые приводят к наравазальным геморрагиям [Закирджаев и др., 1975]. Из других экспериментальных работ известно, что непрямые антикоагулянты угнетают активность фибриназы, что проявляется в снижении эластичности фибринового сгустка [Бронштейн, 1970; Баркаган и др., 1971].
Таким образом, выявлено широкое влияние непрямых антикоагулянтов на систему гемостаза. Действие этих препаратов, как было показано, распространяется на все звенья гемостаза, где возникают определенные функциональные изменения, ведущие к выпадению целых звеньев в каскадном процессе коагуляции.
Сложность и многообразие патологических изменений, возникающих при применении непрямых антикоагулянтов, побудили нас исследовать действие многокомпонентного препарата в эксперименте на животных, которые предварительно в течение 2 сут получали пелентан.
Проведенные исследования позволяют сделать вывод, что в механизме гемостатического действия многокомпонентного отвара имеет значение ряд факторов, из них основным является активация сосудисто-тромбоцитарного звена гемостаза. В наших опытах во всех случаях после применения отвара тибетского препарата значительно повышалось количество тромбоцитов, уменьшалась длительность кровотечения у здоровых и облученных животных, повышался индекс адгезивности кровяных пластинок в опытах с применением ацетилсалициловой кислоты, которая обладает свойством угнетать адгезивность и агрегацию тромбоцитов [Hartweg, 1967].
В физиологических условиях внутренняя поверхность сосудов является несмачиваемой [Luft, 1965; Stemerman et al., 1972]. В то же время исследования, проведенные с помощью электронного микроскопа, показали, что повышение сосудистой проницаемости происходит благодаря округлению клеток эндотелия, выстилающих внутреннюю поверхность сосуда, в результате чего увеличиваются межклеточные пространства [Luft, 1965]. Это приводит к тому, что кровяные пластинки, соприкасаясь с микрофибриллами субэндотелия, расположенного между эндотелиальными клетками и эластической мембраной, начинают адгезировать. Общеизвестно, что вслед за адгезией кровяных пластинок начинаются их агрегация и реакция высвобождения, что приводит к образованию мягкого тромбоцитарного тромба.
В связи с этим, вероятно, что механизм повышения функциональной активности сосудисто-тромбоцитарного звена гемостаза заключается в проявлении функциональных изменений эндотелия микрососудистого ложа, вследствие чего начинается адгезия тромбоцитов. Повышение количества кровяных пластинок и тромбоцитопоэтической активности сыворотки крови, обнаруженное в экспериментах, способствовало повышению гемостатического потенциала.
В настоящее время выявлены универсальные внутриклеточные гормоны (цАМФ и цГМФ), без учета действия которых трудно представить молекулярные механизмы гемостаза. Уровень цАМФ и цГМФ внутри клеток регулируется ферментами аденил- и гуанилциклазами, которые в свою очередь связаны с рецепторами клеточной мембраны. Указанные ферменты активируются разнообразными физическими и химическими факторами. Так, аденилциклаза может переходить в активное состояние под влиянием гормонов гипофиза, простогландинов группы Е, гистамина и других биологически активных веществ, относящихся к адренергическим стимуляторам. В то же время холинергические агенты активируют синтез цГМФ; к ним относятся простогландииы группы F, инсулин, ацетилхолин и др. Активность аденилциклазы и гуанилциклазы связана и зависит от наличия и соотношения многих внутриклеточных факторов, в частности концентрации ионов кальция, калия, магния и т. д. [Федоров, 1979].
Таким образом, принимая за основу существующую теорию о каскадном ферментативном процессе свертывания крови, мы полагаем, что комплекс составных частей, содержащихся в компонентах препарата, является биологически активной комбинацией химических веществ, влияющих на факторы свертывания крови разным образом и способствующих ее ускоренной коагуляции. Особенно важным представляется содержание флавоноидов, дубильных веществ в растительной части препарата и красящих веществ в некоторых растениях, а возможно, и во всех.
Тромбоцитопоэтические свойства тибетского препарата можно отнести за счет содержащихся в его компонентах каротина, шиконина, алконина и, вероятно, хлорофилла, который содержится в надземной части многих растений [Николаева, 1947; Алиев, 1960].
Результат действия большинства компонентов примененного препарата на целостный организм, казалось бы, один и тот же - остановка кровотечения, но осуществляется оно, по-видимому, разными путями.
Организм отвечает на раздражения, в том числе и химические, с весьма большой избирательностью. В соответствии с основными положениями тибетского трактата "Чжуд-ши", "препарат" представляет собой систему либо общеукрепляющего, либо целеустремленного специфического действия на орган-мишень. Поэтому препараты тибетской медицины в основном многокомпонентны, хотя и не исключается применение однокомпонентных.
Наличие в компонентах препарата дубильных, красящих веществ, флавоноидов, алкалоидов, кумаринов обеспечило одновременное влияние этой лекарственной смеси на состояние сосудистой стенки, продукцию кровяных пластинок и плазменную коагуляцию.
Сомнительно, что при введении препарата могли возникнуть деструктивные изменения сосудистой стенки, которые провоцировали бы активизацию динамических функций тромбоцитов и свертывание крови. Вместе с тем под влиянием указанных выше биологически активных веществ могли возникнуть функциональные изменения сосудистой стенки и в том числе эндотелиальных клеток, приводящие в конечном итоге к повышению свертывания крови [Балуда, Лукьянова, 1983]. В механизме формирования гемостатического потенциала взаимодействие между тромбоцитами и эндотелием играет существенную роль. Поэтому выявленные изменения в системе гемостаза (в экспериментах) наводят на мысль о том, что действие препарата осуществляется через простаци-клингенерирующую систему стенки сосудов, где, по-видимому, снижается синтез простациклина [Гаврилов, 1981; Балуда и др., 1983; Vergaftig, Daz-Hai, 1973; Weksler et al., 1977].
Эти свойства биологически активных веществ препарата подтверждены в экспериментах с ацетилсалициловой кислотой, которая является ингибитором циклооксигеназы - фермента, способствующего проявлению динамических функций тромбоцитов. В данном случае нормализация функций сосудисто-тромбоцитарного гемостаза, вероятно, связана с повышением активности циклооксигеназы, тромбоцитов, участвующей в биосинтезе тромбоксана А2 [Петков, 1974; Гаврилов, 1981].
Применяя на нескольких моделях гипокоагуляции в эксперименте на животных отвар многокомпонентного препарата, мы исходили из положения, что нет лекарства с однонаправленным действием [Петков, 1974] - содержание в составе препарата различных химических соединений обусловливало полирецепторное действие. Поэтому повышение свертывающего потенциала крови под влиянием препарата у животных, получавших полентан, очевидно, подвергалось этой закономерности. Наряду с этим, содержание нафтохинонов в препарате подтверждало возможность повышения свертывающей активности крови в условиях пелентановой гипокоагуляции.
Таким образом, в экспериментах установлено, что отвар тибетской лекарственной смеси "Тхаший-тханг" обладает кровоостанавливающим действием. Гемостатическое действие лекарственной смеси реализуется на уровне плазменной и сосудисто-тромбоцитарной коагуляции крови. Повышение свертывающего потенциала крови при однократном введении отвара лекарственной смеси обусловлено повышением тромбопластиновой активности крови; при длительном введении отвара увеличивается концентрация фибриногена. Механизм действия отвара лекарственной смеси реализуется через функции костного мозга, печени, сосудистой стенки и тромбоцитов.
Отвар тибетской лекарственной смеси при однократном введении животным снижает действие пелентана и ацетилсалициловой кислоты на систему гемостаза, повышая гемокоагуляцию и адгезивную функцию тромбоцитов. Глубокие нарушения системы гемостаза при токсическом гепатите сопровождаются диссеминированным внутрисосудистым свертыванием крови. В этом случае отвар лекарственной смеси "Тхаший-тхаиг" повышает свертывающий потенциал крови, что указывает на нормализацию гемокоагуляционной функции печени.
Антиульцерогенные лекарственные средства
В тибетских трактатах при описании заболеваний желудочно-кишечного тракта охарактеризованы проявления синдромокомплекса "бад-кан смуг-по" (букв, лиловая слизь), которые нами расшифровываются как клинические и секционные описания язвенной болезни.
Тибетские ученые описывают изменения слизистой оболочки желудка на разных стадиях развития заболевания, т. е. данные, которые могли быть получены при сопоставлении клинической симптоматики (боль, рвота, диспептические явления, исследование пульса и др.) и секционных наблюдений. Выделяются такие стадии заболевания, как воспалительная, характеризующаяся "насыщенностью кровью" (гиперемией) пораженного участка слизистой оболочки желудка; собственно деструктивная - с момента прободения стенки желудка.
В клинической картине язвенной болезни желудка различается поражение его верхнего отдела, симптомом которого считались рвота массами "дымчато-серого цвета", и нижнего отдела - которое давало себя знать преимущественно как "понос темной кровью". В ряде случаев тибетские источники указывают на возможность трансформации язвы желудка в опухоль ("смуг-по может свернуться, сделаться твердым, как скатанный шарик, и пульсировать при надавливании"). На месте локализации опухоли ("скран") отмечается чувство "жара" [Чжуд-ши, т. III, л. 23]. Тибетские медики клинически различали острую стадию ("жар") и могли улавливать момент хронизации процесса ("застаревание смуг-по"). Соответственно этому выбиралась и тактика лечения. В острой стадии все лечебные мероприятия направлялись па ликвидацию воспалительного процесса и нормализацию функции органа. В стадии хронизации патологического процесса, особенно при появлении опухоли, назначались препараты, направленные на ликвидацию новообразования в желудке путем "раздробления и изгнания" и на активацию репаративных процессов.
В лечении язвенной болезни желудка на всех стадиях широко использовались средства растительного происхождения. По сравнению с основной массой тибетских препаратов прописи, назначаемые при лечении язвенной болезни, отличаются относительно немногочисленным набором компонентов, в среднем от четырех до семи. Они состоят из растений, которые, согласно представлениям тибетских медиков, обладают общим противовоспалительным ("уничтожают жар"), нормализующим функцию органа ("усиливают огонь желудка"), гемостатическим ("связывают устья сосудов") действием. Большое значение придавалось нормализации взаимоотношений функций желудка с другими органами системы пищеварения (печень, кишечник). В качестве лечебных средств в прописи вводили тростниковый сахар и мед. По-видимому, это делалось с целью доставки в организм легко усвояемого энергетического субстрата. Для регуляции электролитного и микроэлементного состава внутренней среды организма в "препарат" включали минералы и вещества, содержащие микроэлементы. Большое значение придавалось также детоксирующей терапии. В качестве очистителей больным предписывали пить свиную кровь и препараты из барбариса. Наконец, для поддержания достигнутого клинического эффекта предшествующей терапии по завершении курса лечения часто назначались виноград, солодка и некоторые виды желчи.
Путем отбора сочетаний растений с заданным спектром биологической активности [Асеева и др., 1985] мы выбрали из многокомпонентных прописей, назначаемых в тибетской медицине при язвенной болезни желудка, две лекарственные смеси: 1 - плоды миробалана хебула, корневища марены сердцелистной, корневища софоры желтоватой (Я1); 2 - корневища с корнями девясила высокого, плоды облепихи крушиновой, плоды кориандра посевного (Я3). Судя по "Чжуд-ши" и "Вайдурья-онбо", эти композиции, кроме антиульцерогенной активности, должны обладать достаточно широким спектром действия.
Цель исследования состояла в определении антиульцерогенной активности препаратов, используемых в тибетской медицине для терапии состояний, схожих по клинической картине с неосложненной и осложненной формой язвенной болезни. Проведено несколько серией экспериментов.
В первой серии экспериментов на трех моделях язвы желудка: по И. С. Заводской [1954], Shay et al. [1945], Okabe et al. [1971] - выяснялось наличие у данных смесей антиульцерогенной активности. Во второй серии с целью выявления механизма антиульцерогенного действия определялась антиоксидантная (на модели язвы желудка по Okabe), антигистаминная активность лекарственных сборов,.
Выбор этих тестов основан на анализе данных литературы, посвященных изучению патогенеза язвенной болезни. Показано, что процесс перекисного окисления линидов как один из наиболее фундаментальных механизмов цитопатологии [Владимиров, Лрчаков, 1972; Прайор, 1979] участвует в патогенезе язвенной болезни [Куликов и др., 1979, 1980], а антиоксиданты оказывают эффективное антиульцерогенное действие в эксперименте [Меерсон, 1981] и клинике [Корочкин, Пославский, 1983]. Нарушение обмена гистамина имеет большое значение в реализации гормонально-гуморальных дисфункций при развитии язвенной болезни [Бурчииский, Кушнир, 1973], а блокаторы гистаминовых рецепторов занимают одно из ведущих мест в современной терапии язвенной болезни [Гребенева, Цветкова, 1983].
Сборы Я1 и Я3 применяли в лекарственных формах, рекомендуемых тибетской медициной. Сбор Я1 готовили в форме отвара: порцию препарата, из расчета 300 мг суховоздушной массы на 1 кг массы животных, кипятили в дистиллированной воде в течение 4-5 мин, давали отстояться, фильтровали и доводили объем до исходного из расчета 1 мл отвара на 100 г массы экспериментального животного. Препарат готовили ex tempore. Вводили внутрижелудочно через зонд. Сбор Я3 (300 мг/кг, внутрижелудочно) использовали в виде водной взвеси порошка с размером частиц не более 0,25 мм.
В качестве препарата для сравнения использовали витамин U (1000 мг/кг, внутрижелудочно), широко применяемый в терапии язвенной болезни. Механизм действия этого препарата связывают со способностью S-метилметионинсульфония быть донатором метильных групп, являющихся пластическим материалом, необходимым для обеспечения процессов регенерации [Циммерман и др., 1973; Машковский, 1986].
Опыты проведены на белых беспородных крысах обоего пола с исходной массой 150-200 г. Экспериментальное повреждение желудка по методу И. С. Заводской [1954] воспроизводили на крысах массой 180-200 г, предварительно голодавших 48 ч при свободном доступе к воде. Исследуемые сборы и витамин U вводили за 20-30 мин до операции и через 5 ч после нее. Животные контрольной группы в этой серии так же, как и в последующих, получали дистиллированную воду. Животных декапитировали через 24 ч после операции. Желудки вскрывали по большой кривизне, подсчитывали число деструкции и рассчитывали для них индекс Паулса [Хаджай, Оболенцева, 1962].
Модель язвы желудка по методу Shay et al. [1945] воспроизводили на крысах обоего пола массой 180-200 г, Схема введения исследуемых препаратов, как и весь ход эксперимента, повторяла предыдущий. Модель хронической ацетатной язвы желудка по методу Okabe et al. [1071J воспроизводили па животных массой 150-180 г. Под гексеналовым наркозом (50 мг/кг, внутрибрюшинно) производили срединную лапаротомию, желудок выводили в рапу, к передней стенке его прикладывали кольцо из пластмассы с внутренним диаметром 5 мм и в просвет кольца на серозную оболочку наносили две-три капли ледяной уксусной кислоты. Через 1 мин кислоту удаляли фильтровальной бумагой, серозную оболочку промывали физиологическим раствором и брюшную полость послойно зашивали шелковыми нитками. После оперативного вмешательства животные в течение всего периода экспериментов получали обычную пищу. Исследуемые препараты вводили с первого дня экспериментов в течение 14 дней. Контрольные животные получали дистиллированную воду. Животных выводили из эксперимента на 7, 14, 21, 28 и 35-е сутки с момента начала опытов. Желудки вскрывали по большой кривизне, осматривали слизистую оболочку под бинокулярной лупой, производили морфометрию кратера. Для гистологических исследований в месте повреждения вырезали кусочек слизистой, фиксировали его в нейтральном 10%-ном формалине. Срезы окрашивали гематоксилин-эозином [Волкова, Елецкий, 1982].
Влияние сбора Я3 и витамина U на интенсивность процессов нерекисного окисления липидов (ПОЛ) в стенке желудка и внутренних органах при ульцерогенезе исследовали на модели язвы желудка по Okabe et al. на 14-е и 28-е сутки от начала экспериментов. Для этого в гомогенатах определяли содержание одного из вторичных продуктов перекисного окисления липидов - МДА [Стальная, Гаришвили, 1977]. Синдром цитолиза оценивали в те же сроки по активности сывороточных ферментов-маркеров цитоплазматических и лизосомальных мембран - АЛТ, ACT, кислой и щелочной фосфатазы (стандартные наборы "Химреактивкомплект", г. Купавна Московской области). О состоянии экскреторно-поглотительной функции печени судили по бромсульфалеиновому тесту (50 мг/кг бромсульфалеина внутривенно). Внешнесекреторную функцию поджелудочной железы оценивали по активности сывороточной амилазы. О степени выраженности деструктивных процессов в этом органе судили по величине амилазокреатининового индекса; Состояние экскреторного аппарата почек оценивали по уровню креатинина в сыворотке крови и моче.
В сериях дополнительных экспериментов со сбором Я3, витамином U и кверцетином исследована антигистаминная активность с использованием методики "меченых" сосудов [Горизонтова и др., 1975], активность энзимной системы монооксигеназ со смешанной функцией (по тесту с гексеналовым сном - 60 мг/кг, внутрибрюшинно, однократно). В этих опытах препараты вводили однократно за 2 ч до начала экспериментов.
Результаты экспериментов обработаны математико-статистическими методами с использованием коэффициента Молденгауэра и критерия U Вилкоксона - Манна - Уитни и представлены в таблицах.
При воспроизведении модели язвы желудка по методу Заводской (табл. 42) в группе контрольных животных полосовидные язвы различной степени протяженности развились в 41% случаев, носили единичный характер, в связи с чем индекс Паулса был небольшим и составил лишь 0,01. В группах животных, получавших витамин U, сборы Я4 и Я3, эти поражения не развились. Образование множественных эрозий отмечено у 100% животных контрольной группы, у 60%, получавших витамин U и сбор Я1, и в 50% случаев при использовании Я3. При применении витамина U индекс Паулса по сравнению с контролем был меньше в 3,61 раза, при использовании сборов Я1 и Я3 - в 3,67 и 5,5 раза соответственно.
В случае воспроизведения язвы желудка по методу Shay et al. (см. табл. 42) полосовидные язвы не развились ни в одной группе экспериментальных животных. Эрозии в группе контроля обнаруживались в 80% случаев. В группе получавших витамин U в 40% случаев, в группе Я4 - у 60% и в группе Я3 - в 50% случаев. Индекс Паулса уменьшился при применении витамина U в 3,44 раза, а в группах, получавших сбор Я4 и Я3,- в 2,38 и 2,86 раза соответственно.

Таблица 42. Влияние сборов Я1, Я3 и витамина U на возникновение деструкции желудка у крыс на моделях острых язв желудка
(Примечание. Индекс Паулса: 1 - для полосовидных язв; 2 - для эрозий.)
На 7-е сутки течения ацетатной язвы желудка по Okabe в группе крыс, получавших сборы Я1 и Я3, макроскопическая картина характеризовалась сглаженностью рельефа слизистой оболочки желудка, ее некоторой гиперемией, инъецированием сосудов вокруг язвенного дефекта. Поверхность язвенного поражения отделялась от пограничной слизистой оболочки ярко выраженным демаркационным воспалительным валом. На дне язвенных кратеров обнаруживались гнойно-некротические массы. В обеих экспериментальных группах у крыс отмечались спайки между близлежащими органами, в большинстве случаев между печенью и желудком. Кроме того, в этот срок эксперимента выявлено нарушение тонуса гладкой мускулатуры желудка, которое проявлялось в форме гастростаза и в перерастяжении его стенок.
К 21-м суткам наблюдения между сравниваемыми группами обнаруживались некоторые различия. Так, У экспериментальных животных, получавших лекарственную смесь Я1 (I группа), спайки между печенью и желудком обнаружены в пяти случаях из девяти (55,5%), тогда как у крыс, принимавших лекарственную смесь Я3,- во всех наблюдениях. Нарушение тонуса гладкой мускулатуры желудка в I группе (Я,) не зафиксировано ни в одном, а во II (Я3)-во всех наблюдениях. Такая же закономерность отмечена и в отношении рубцевания язвенного дефекта. В I группе процент заживления язвенных дефектов неуклонно рос и достиг к 35-м суткам 100 (табл. 43). В то же время во II группе на 14, 21 и 28-е сутки эксперимента процент заживления составил 75,0; 87,5 и 83,4 соответственно.

Таблица 43. Заживление язвенных дефектов но группам животных, получавших лекарственную смесь Я1, Я3 и витамин U,%
При использовании витамина U выявлено следующее: на 14-е сутки эксперимента заживления язвенного дефекта не выявлено ни в одном случае, хотя отмечался некоторый положительный эффект, который характеризовался заживлением послеоперационного шва (неполным), отсутствием гнойно-некротических масс в дне кратера, нормализацией рельефа слизистшТ оболочки желудка. К 28-м суткам экспериментальных исследований заживление язвенного дефекта в этой группе отмечено в 23,4% случаев. Кроме того, положительный эффект от применения препарата состоял в увеличении числа животных, имевших полное заживление послеоперационного шва.
В контрольной группе экспериментальньтх животных вплоть до 28-х суток эксперимента заживления язвенного дефекта не отмечено и только на 35-е сутки язвенная поверхность зарубцевалась у 5,4% крыс. Причем выявлялись спайки между близлежащими органами и стенкой желудка во все сроки эксперимента. Нарушение тонуса гладкой мускулатуры стенки желудка сопутствовало всем животным и во все сроки наблюдения.
Наблюдение за группами экспериментальных животных показало, что при использовании лекарственной смеси Яя послеоперационный период протекал более гладко по сравнению с контрольной группой: уменьшался падеж животных - 15,7% особей (6 из 38), послеоперационные осложнения возникали у меньшего числа крыс (21% - у восьми из 38). Воспаление послеоперационного шва выявлепо у 16 из 38 животных (42,1%), изъязвление у 4 животных (10,5%). Полное заживление шва с начальным оволосением на 14-е сутки отмечено у шести из восьми животных (75%), пленочные, а также висцеровисцеральные спайки встречались у единичных животных. В трех случаях не обнаружено спаек между печенью и стенкой желудка, в двух - отмечено локальное сращение этих органов и в трех наблюдениях печень была тотально сращена с желудком. На 28-е сутки опыта полное заживление послеоперационного рубца выявлено у всех животных. Спаек между органами в брюшной полости не обнаружено.
В целом эти закономерности отмечены и при использовании лекарственной смеси Я4. Имеющиеся различия заключались в том, что при использовании Я4 полное заживление послеоперационного шва наступало раньше (10-е сутки эксперимента), послеоперационные осложнения выявлялись у меньшего числа животных, отсутствие спаечного процесса между органами брюшной полости также отмечено уже на 10-е сутки опыта.
В контрольной группе погибло 48,3% особей (29 из 60 крыс), кроме того, очень часто встречались различные послеоперационные осложнения - 88,3% (у 53 из 60) от числа всех животных данной группы, был более выражен спаечный процесс в брюшной полости. Полное заживление послеоперационного шва наблюдалось у немногих животных и только к концу эксперимента, т. е. на 35-е сутки.
Площади кратеров язвы при использовании лекарственных смесей Я4 и Я3 также были различными (табл. 44). В контрольной группе во все сроки опыта они значительно превышали таковые в группах, где животные принимали лекарственные смеси.

Таблица 44. Средняя площадь кратеров язвы у животных, получавших смеси Я1, Я3 и витамин U по сравнению с контрольной группой, мм2
(Примечание. Достоверность различий по показателям всех опытных групп в сравнении с контролем составляет значение Р0,05.)
Таким образом, лекарственные смеси Я4 и Я3, являющиеся фрагментами многокомпонентных композиций тибетских прописей, обладают антиульцерогенной активностью.
Итак, в контрольной группе крыс во все сроки исследования выявлялись язвенные дефекты. При гистологическом исследовании дно их было представлено некротическими массами, инфильтрированными лейкоцитами, преимущественно нейтрофильными. Все слои стенки желудка были резко расширены. В областях, прилежащих к краям язвенного дефекта, обнаруживались резко расширенные железы. Эпителий их был уплощен, с дегенеративными явлениями. Во всех слоях стенки желудка отмечались лейкоцитарная инфильтрация, повышенное слущивание поверхностного эпителия в просвет желудка. Клетки эпителия также были с явлениями дегенерации, ядра сдвинуты в апикальную сторону. Выявлялись резко выраженные микроциркуляторные нарушения в сосудах в виде полнокровия и стаза форменных элементов крови. Балочная структура ткани печени, прилегающей к дну язвенного кратера, нарушена, границы между гепатоцитами нечеткие. Печеночные клетки имели зернистость и вакуолизированную цитоплазму. Ядра некоторых клеток пикнотизированы. Вокруг сосудов и в перипортальных трактах встречалось множество круглоклеточных элементов. Купферовские клетки увеличены в размерах, набухшие. В сосудах отмечались стаз и полнокровие. Во все последующие сроки эксперимента ни в одном случае не обнаружено заживления язвенного дефекта. Только к 35-м суткам отмечено некоторое уменьшение воспалительных и дегенеративных изменений в ткани печени.
На 7-е сутки экспериментальных исследований у животных, получавших лекарственную смесь Я3 (I группа), выявлялась зона обширного некроза всех слоев стенки желудка. Дно язвы было представлено некротическими массами, обильно инфильтрированными лейкоцитами, среди которых преобладали полиморфно-ядерные формы, встречались эозинофилы, плазматические клетки, лимфоциты, макрофаги. В краях язвы клетки эпителия формировали кистознорасширенные железы. Поверхностный эпителий слизистой оболочки, находящийся в некотором отдалении от области повреждения, выглядел несколько уплощенным, цитоплазма мукоцитов была менее прозрачной, ядра выявлялись не во всех клетках и не везде располагались базально, величина их была различной. Стопки желудка умеренно утолщена за счет отека и инфильтрирована форменными элементами крови, преимущественно полиморфно-ядерными лейкоцитами. Железы желудка в этой области также имели признаки деструкции и дегенеративных изменений. Кроме того, морфологическим изменениям эпителия сопутствовали нарушения микроциркуляторного русла, которые проявлялись полнокровием и расширением вен, стазом форменных элементов крови в венозных и артериальных сосудах. Появлялись единичные фибробласты.
Таким образом, на 7-е сутки фиксировалось формирование язвы с характерными для нее морфологическими признаками. В периульцерозной области выявлялись морфологические признаки гастрита (отек стромы, лейкоцитарная инфильтрация, дегенеративные изменения кан поверхностного эпителия, так и желез, размытость границ между клетками, дистопия ядер, уплощение поверхностного эпителия). Грануляция в дне язвенного кратера непосредственно прилегала к ткани печени. Капсула печени отсутствовала. В печеночной ткани балочная структура была нарушена, границы между гепатоцитами нечеткие. Встречались единичные двухъядерные клетки. Вокруг сосудов и по перипортальным трактам выявлялась инфильтрация круглоклеточными элементами. Цитоплазма некоторых гепатоцитов была вакуолизирована. Встречались единичные лимфогистиоцитарные инфильтраты в строме органа. Купферовские клетки выглядели набухшими. В сосудах выявлялись полнокровие и стаз форменных элементов крови.
У животных, получавших лекарственную смесь Я4 (II группа), гистологическая картина изменений слизистой оболочки желудка соответствовала I группе с той лишь разницей, что в ткани печени круглоклеточная инфильтрация вокруг сосудов и по перипортальным трактам выражена меньше. Выявлялись двухъядерные и гиперхромные гепатоциты.
На 14-е сутки эксперимента на гистологических препаратах у животных в I группе обнаруживается развитие грануляционной ткани, представленной сосудами с утолщенной стенкой, клеточными элементами, среди которых преобладали эозинофилы, затем гистиоциты, полиморфно-ядерные лейкоциты, лимфоциты, плазматические клетки и фибробласты. В краях язвы продолжали выявляться кистозно-расширенные железы, в просветах которых видно скопление гранул секрета. В этот период уменьшаются дегенеративные изменения в мукоцитах и в эпителии желез, а также отек стромы органа. В значительно меньшем количестве выявлялась клеточная инфильтрация, причем преобладали эозинофилы, хотя нейтрофильные лейкоциты все же обнаруживались. Нарушения в микроциркуляторном русле выявлялись реже. По окраске но Ван-Гизону выявлялись коллагеновые волокна, которые наползали с краев язвенного дефекта. В печеночной ткани балочная структура восстанавливалась, границы между гепатоцитами становились четкими. Уменьшилось число клеток с вакуолизированной цитоплазмой. Лейкоцитарная инфильтрация вокруг сосудов и по перипортальным трактам также стала выявляться реже. Уменьшились изменения в микроциркуляторном русле. Число двухъядерных и гиперхромных гепатоцитов увеличилось.
Во II группе (Я1) в гистологических препаратах желудка так же, как и в I группе, выявлялось образование грануляционной ткани. Дегенеративные изменения в поверхностном слое эпителия и эпителии желез уменьшились. Так же, как и в I группе, значительно реже стали выявляться признаки сопутствующего гастрита. Имеющиеся различия касались гистологической картины ткани печени, выполняющей роль дна язвенного кратера. На данный период эксперимента морфологическая картина тканевой структуры печени соответствовала таковой у интактных животных.
На 21-е сутки наблюдения в I группе подопытных животных на гистологических препаратах желудка в тех локусах, в которых была индуцирована ацетатная язва, выявлены примитивные железы типа пилорических. Явления реактивного периульцерозного гастрита уменьшились. Язвенные кратеры полностью заполняла грануляционная ткань. В ней выявлялось множество фибробластов. Окраска по Ван-Гизону показала, что коллагеновые волокна были толстыми и, достигали уровня подслизистого слоя. В печени структура ткани почти полностью восстановилась. Инфильтрация вокруг сосудов и по перипортальным трактам была незначительной. Гепатоциты с дистрофическими явлениями не выявлялись.
Во II подопытной группе крыс гистологическая картина соответствовала таковой в I группе. На месте бывших дефектов стенки желудка выявлялись вновь образованные железы, в которых отсутствовали обкладочные клетки. Грануляционная ткань была достаточно развита, встречалось множество фибробластов. Окраской по Ван-Гизону выявлялись хорошо развитые коллагеновые волокна. Ткань печени соответствовала нормальной. Такая гистологическая картина отмечалась па 35-е сутки эксперимента.
В группе животных, получавших витамин U, на гистологических препаратах в ранние сроки (7-е и 14-е сутки) выявлялся обширный некроз стенки желудка с обильной инфильтрацией нейтрофильными лейкоцитами. Поверхностный эпителий по краям язвы представлен в виде различной степени деструктивно измененных клеточных элементов. Отмечается повышенная его десквамация в просвет желудка. В областях, отдаленных от язвенного дефекта, обнаруживались отек стромы органа, массивная клеточная инфильтрация, дегенеративные изменения поверхностного эпителия и клеток желез, микроциркуляторные нарушения. Окраска по Ван-Гизону выявила единичные коллагеновые волокна. В ткани печени балочная структура нарушена, границы между клетками смазаны. Отмечалась обильная инфильтрация круглоклеточными элементами. Цитоплазма большинства гепатоцитов вакуолизирована, ядра пикнотически изменены, встречались клетки с зернистостью в цитоплазме. Пространства Диссе расширены. Купферовские клетки были набухшими.
Вплоть до 28-х суток наблюдения в этой группе не отмечено полного заживления язвенного дефекта. В гистологической картине наблюдались проявления гастрита и неспецифического реактивного гепатита.
Таким образом, при применении тибетских лекарственных смесей Я1 и Я3 у животных с экспериментальной язвой желудка положительный эффект заключался в следующем: более раннем заживлении язвенных дефектов; большем проценте заживления их по сравнению с контрольной группой; уменьшении размеров площади язв; наличии противовоспалительного действия, которое проявлялось в отсутствие спаечного процесса у большинства животных, получавших лекарственные смеси; нормализации тонуса гладкой мускулатуры стенки желудка. Кроме того, при применении этих смесей раньше был ликвидирован морфологический субстрат неспецифического реактивного гепатита, который выявлялся при экпериментальной язве желудка, тогда как при использовании витамина U он сохранялся гораздо дольше.
Таким образом, по результатам проведенных серий экспериментов можно заключить, что тибетские лекарственные смеси проявили выраженное гастропротективное действие на моделях острых язв желудка и язвозаживляющее - на модели хронической язвы желудка по Okabe. Причем на последней модели язвы желудка для лекарственных смесей Я1 и Я3 установлено более выраженное, чем для витамина U, язво- и ранозаживляющее действие, а также антиспаечный эффект. Интересно при этом отметить, что исследуемые сборы Я4 и Я3 на моделях острого повреждения желудка дали приблизительно одинаковый с витамином U результат. Этот эффект может объясняться особенностями лекарственной формы препаратов, не являющихся чистыми в химическом отношении соединениями и поэтому обладающих замедленной в сравнении с витамином U фармакокинетикой и фармакодинамикой, достаточными для купирования патологических явлений, характерных для патогенеза острых язв желудка. Данное предположение может войти в кажущееся противоречие с результатами других экспериментов, в которых за достаточно короткий период времени (минуты, часы) может быть получен выраженный фармакологический эффект, но при этом не следует забывать, что противоязвенный эффект весьма сложен по своему биологическому содержанию и включает в качестве составляющих противовоспалительный, спазмолитический, антигистаминный и т. д., каждый из которых может быть реализован за короткий промежуток времени острого опыта, но в конечном итоге не привести к развитию такого интегративного фармакологического свойста, как гастропротекция.
Вообще складывается впечатление, что тибетские многокомпонентные препараты оказывают более выраженный фармакологический эффект на моделях хронических патологических процессов, имеющих более сложный, чем модели острых патологических состояний, патогенез, а значит, и более широкую метаболическую платформу развития. Именно на таких моделях может быть получена наиболее адекватная и корректная информация о патогенезе патологических процессов и действительной эффективности исследуемых в плане экспериментальной фармакотерапии препаратов. Поэтому в дальнейших экспериментах мы делаем акцент на использовании именно таких моделей патологических состояний. Модели острых опытов привлекали лишь для проверки некоторых выводов, вытекающих из интерпретации результатов, полученных при проведении хронических экспериментов.
В дальнейших сериях опытов предпринято более углубленное изучение механизма действия лекарственной смеси Я3 как равноценной в фармакологическом и более перспективной в фармацевтическом аспекте, чем лекарственный сбор Я1, препарата.
Развитие язвы желудка по Okabe на 14-е сутки сопровождается активизацией процессов ПОЛ в органах системы пищеварения, почках и сыворотке крови, что подтверждается увеличением уровня МДА в них (табл. 45). Отличия от показателей интактной группы носят высокий уровень статистической значимости и к 28-м суткам эксперимента, что хорошо коррелирует с глубиной и масштабами язвенного дефекта в желудке и выраженностью спаечного процесса в брюшной полости. На развитие синдрома цитолиза указывает также увеличение сывороточных маркерных ферментов - АЛТ, ACT и кислой фосфатазы (табл. 46). Так, на 14-е сутки эксперимента их активность выше, чем в группе интактных животных, на 217,8% (Р<0,001); 202,2 (Р<0,001) и 246,2% (Р<0,001) соответственно. Отмечается увеличение активности щелочной фосфатазы в сыворотке крови па 133,3% (Р<0,001), что свидетельствует о развитии синдрома холестаза в печени и деструктивных процессов в 12-перстиой кишке. Этот показатель хорошо коррелирует с повышением уровня МДА в печени и 12-перстпой кишке. Следует отметить, что ферментные констилляции не нормализуются и к 28-м.суткам эксперимента: активность АЛТ остается повышенной на 116,9% (Р<0,001), ACT на 134,8% (Р<0,001), кислой фосфатазы на 43,1% (Р<0,05) и щелочной фосфатазы на 74,0% (Р<0,01). Параллельно уровню МДА в печени и щелочной фосфатазы в сыворотке крови происходит уменьшение клиренса бромсульфалеина при проведении нагрузочной пробы: на 14-е сутки в 5,5 раза меньше уровня интактных животных (Р<0,005), а на 28-е сутки остается пониженным в 3,4 раза (Р<0,005), что свидетельствует о значительном снижении функциональной активности печени.
Таблица 45. Содержание МДА в гомотогенах органов крыс с ацетатной язвой желудка по Okabe и экспериментальной ее фармакотерапии смесью Я3 и витамином U, нмоль/г
Использование витамина U для экспериментальной фармакотерапии язвы желудка проявляло выраженный позитивный эффект не только в отношении морфологического субстрата, но также и в аспекте нормализации биохимического гомеостаза организма подопытных животных. Так, на 14-е сутки эксперимента достоверно снижалось содержание уровня МДА во всех исследуемых органах и сыворотке крови, за исключением почек, что может объясняться преимущественным действием препарата на органы системы пищеварения. Такая же тенденция отмечена и на 28-е сутки эксперимента, лишь с тем отличием от показателей, характерных для 14-х суток, что достаточно слабое действие препарата проявлялось не только в отношении почек, но и 12-перстной кишки (в сравнении с контролем), хотя уровень МДА в тонком кишечнике был лишь на 11,8% больше соответствующего показателя для интактной группы. Об уменьшении тяжести синдрома цитодеструкции под влиянием витамина U свидетельствует также динамика активности сывороточных ферментов. Так, в ряду АЛТ-ACT - кислая фосфатаза - щелочная фосфатаза на 14-е сутки опыта отмечено уменьшение по сравнению с контролем па 17,4% (Р<0,05), 24,5 (Р<0,05), 44,0 (Р<0,05) и 26,0% (Р<0,005). К 28-м суткам эта разница составляла 43,0% (Р<0,05), 39,2 (Р<0,05), 22,0 (Р>0,05) и 16,2% (Р<0,05). Все эти показатели достаточно далеки от показателей группы интактных животных, и это свидетельствует о незавершенности патологического процесса не только в локусе язвенного дефекта - желудке, но также в смежных и достаточно отдаленных от него в анатомо-функциональном плане органах (например, в почках). В полной мере с этими показателями коррелируют данные БСФ-теста: на 14-е сутки концентрация бромсульфалеина в крови в данной опытной группе составляет 71,0% (Р<0,01), а па 28-е сутки 65,9% (Р<0,05) от соответствующего показателя контрольной группы и 391,0 и 216,0% по сравнению с интактной.
При экспериментальной фармакотерапии язвы желудка по Okabe у крыс растительной смесью Яз процессы ПОЛ во внутренних органах ингибируются в гораздо большей степени, чем при применении витамина U. Так, па 14-е сутки уровень МДА в гомогенатах желудка меньше, чем в контроле, на 42,2% (Р <0,005) и на 12,8%, чем в группе витамина U. Особенно сильно антиоксидантный эффект сбора Я3 проявился для почек и 12-перстной кишки: разница с контролем и группой витамина U составила соответственно 37,7% (Р<0,01) и 30,0 (Р<0,05), 35,8 (Р<0,005) и 22,2% (Р<0,05). Весьма интересным представляется факт резкого угнетания активности ПОЛ в тонком кишечнике: уровень МДА в 12-перстной кишке становится даже несколько ниже, чем в группе интактных животных, - на 17,5%. Некоторое исключение составлял этот показатель для печени: с высоким уровнем достоверности отличаясь от показателя контрольной группы - меньше на 23,1% (Р<0,01), он был несколько выше, чем соответствующий показатель группы витамина U. Выраженный антиоксидантный эффект лекарственного сбора Я3 на уровне целостного организма демонстрируется по уровню МДА в сыворотке крови. Этот показатель меньше, чем в контроле, на 40,4% (Р<0,005) и на 23,7% (Р0,05) ниже показателя группы витамина U. Качественно та же картина наблюдается и для других биохимических показателей, использованных в данном эксперименте: АЛТ, ACT, кислая и щелочная фосфатазы, БСФ-тест (см. табл. 46). Они были меньше соответствующих показателей контрольной группы, что свидетельствует о мембранопротективном эффекте препарата и позитивном действии на функциональные отправления органов, в частности печени. Следует отметить тот факт, что, хотя активность ПОЛ в печени крыс, получавших сбор Я3, находится на одном уровне с таковой у крыс группы витамина U, бромсульфалеиновый тест выявил более высокий уровень активности этого органа у крыс I группы: бромсульфалеиы в крови был меньше, чем в группе витамина U, на 16,3% (Р<0,05).

Таблица 46. Активность ферментов сыворотки крови у крыс с язвой желудка по Okabe при экспериментальной фармакотерапии смесью Я3 и витамином U
(Примечание. Р - достоверность отличий: контроль - с иптактными показателями; в случае опытных групп - с показателями контроля.)
Исходя из этого наблюдения, можно сделать следующие предположения. Во-первых, сбор Я3 оказывает более разностороннее и выраженное, чем витамин U, позитивное действие на состояние печени подопытных животных, усиливая не только системы антиоксидантной защиты мембраносвязанных энзимных ансамблей, в частности ферментов детоксикации, но и мобилизуя другие механизмы, в частности холеретический, что купирует синдром внутрипеченочного холестаза (тест со щелочной фосфатазой был равен 0,32 от уровня контроля и 0,43 от уровня группы витамина U) и оптимизирует состояние гомеостаза в органе; во-вторых, перекисное окисление липидов является, видимо, не единственным молекулярным механизмом повреждения внутриклеточных мембраносвязанных ансамблей, и, в-третьих, "цена", которую платят клеточно-тканевые структуры в морфологическом и биохимическом аспектах за прирост 1 моль перекисей липидов при различных резервах гомеостаза и, в частности, антиоксидантного, бывает различной.
Мы склонны предположить, что в данном случае срабатывает первый механизм: усиление холереза уменьшение холестазаоптимизация внутрипеченочного гомеостаза, что, в частности, продемонстрировано в эксперименте, и третий - повышение резервов антиоксидантов при имеющемся уровне активности ПОЛ в органе.
На 28-е сутки опыта позитивные сдивиги в перекисном обмене исследуемых органов закрепляются и уровень МДА достоверно отличается от уровня показателей контрольной группы. Качественная направленность изменения уровня МДА в гомогенатах органов системы пищеварения, почках и сыворотке крови в целом соответствует картине 14-х суток эксперимента, отличаясь от нее только количественно. При этом следует отметить тот факт, что уровень МДА в печени опытных (т.е. получавших сбор Я3) крыс был значительно, на 24,2% (Р0,05), ниже, чем в группе витамина U. При этом два других показателя, характеризующих состояние печени, - бромсульфалеиновый тест и активность щелочной фосфатазы - также были значительно меньше аналогичных показателей группы препарата сравнения - на 37,0 и 27,2% соответственно. Как и в предыдущий срок исследования, содержание МДА в гомогенатах 12-перстной кишки не только достоверно отличалось от соответствующих показателей группы препарата сравнения, но и было ниже уровня интактных животных. Отсюда можно сделать следующие предположения: или препарат обладает определенной энтеротронностью действия; или препарат поступает в топкий кишечник в несколько активированном виде, в связи с биотрапсформацией в кислотно-гидролитических средах желудка; или среди биологически активных веществ препарата много жирорастворимых, в частности, эссенци-альных жирных кислот (предшественников синтеза про-стагландинов), каротина, токоферолов и других, поступление которых в организм происходит через тонкий кишечник, где они могут в значительной степени реализовать свой антиоксидантный эффект. Независимо от механизма, за счет которого проявляются энтеропротективные свойства препарата, сам факт заслуживает пристального внимания и может служить обоснованием для более широкой постановки экспериментов в аспекте фармакотерапии патологии кишечника.
Таким образом, результаты проведенных двух серий экспериментов свидетельствуют о том, что растительный сбор Я3 оказал более выраженное, чем витамин U, язвозаживляющее действие на организм подопытных крыс с экспериментальной язвой желудка по Okabe. Мембраностабилизирующий эффект препаратов (Я3 и витамина U) может быть связан с ингибированием процессов пол во внутренних органах, активация которых наблюдается при формировании и течении язвы желудка по Okabe. Кроме этих эффектов, установлено нормализующее функцию печени действие испытуемых препаратов. Поскольку при анализе данных эксперимента был отмечен некоторый диссонанс между уровнем МДА в печени и способностью ее выполнять экскреторно-детоксирующую функцию (по БСФ-тесту), при использовании сбора Я3 поставлена задача на модели гексеналового сна установить возможность его влияния на активность микросомальных монооксигеназ, поскольку именно с этим ферментным ансамблем связывают в настоящее время процессы биотрансформации гексенала.
Кроме того, представляло интерес уточнить вопрос о возможности коррекции синдрома отраженной патологии не только в печени, но также в другом органе системы пищеварения - поджелудочной железе, а также почках - парном органе, не входящем в эту функциональную систему. Для этого на модели хронической язвы желудка по Okabe исследовали показатели, отражающие функциональное состояние этих органов - амилазо-креатининовый индекс, активность амилазы в сыворотке крови и сопоставляли эти параметры с активностью процессов ПОЛ в исследуемых органах.
Поскольку витамин U проявил недостаточно высокую антиоксидантную, как, впрочем, и противоязвенную активность, в дальнейших экспериментах в качестве препарата сравнения нами использован флавоноид кверцетин, для которого установлена выраженная противоязвенная [Оболенцева и др., 1974; Барнаулов и др., 1982], антирадикальная и антиоксидантная активность [Петрусевич, 1975; Барабой, 1976].
В эксперименте использованы крысы-самцы массой 150-180 г. Исследуемые фармакологические агенты - Я3 (300 мг/кг) и кверцетии (50 мг/кг) вводили внутрижелудочно в течение 14 дней. После последнего введения препаратов крыс на сутки лишали пищи при свободном доступе к воде. Гексенал (60 мг/кг) вводили внутрибрюшинно, однократно, при тщательном индивидуальном дозировании. Фиксировали время до засыпания (латентная фаза) и время до начала попыток занять произвольную позу тела (время просыпания). В каждой группе использовано по 10 крыс. Результаты экспериментов, представленные в табл. 47, свидетельствуют о том, что исследуемые препараты качественно по-разному влияют на первую фазу снотворного действия гексенала: кверцетин на 17,0% (Р<0,05) сокращает время засыпания, а растительный сбор Я3 значительно - на 86,8% (Р<0,001)- увеличивает длительность латентной фазы.

Таблица 47. Влияние кверцетина и сбора Я3 на течение гексеналового сна у белых крыс
Что касается времени собственно фазы сна, то действие препаратов носило однонаправленный характер, но количественно отличный друг от друга: кверцетин сокращал время сна на 16,8% (Р<0,05), а Я3 - на 66,7% (Р<0,001).
При интерпретации результатов данного фармакологического опыта допустимо утверждение о том, что препараты увеличивают активность энзимных систем в печени, метаболизирующих ксенобиотики, что перекликается с данными о стимулировании детоксирующей функции печени при экспериментальной фармакотерапии язвы по Okabe сбором Яз. Кроме того, это подтверждает предположение о прямом, опосредованном не только антиоксидантным эффектом, действии биологически активных веществ комплекса Я3 на систему ферментов, ответственных за функцию детоксикации печени. Тем не менее полученные экспериментальные данные не уменьшают актуальности двух других высказанных выше предположений, которые нуждаются в экспериментальной проверке.
Уменьшение времени лаг-фазы в действии гексенала на фоне курсового введения кверцетина свидетельствует о его потенцирующем по отношению к снотворному препарату действии. Не исключено, что препарат сам обладает некоторым седативным действием, чем в определенной степени может объясняться его гастропротективный аффект, установленный на моделях нейрогенных дистрофий, а не только "сосудоукрепляющим", как утрированно объясняют некоторые авторы большинство из его фармакотерапевтических эффектов.
Что касается сбора Я3, то его противоположное по сравнению с кверцетином действие на длительность засыпания может объясняться некоторым психостимулирующим влиянием, природа которого в настоящее время не совсем ясна и требует своего экспериментального изучения. Не исключено, что будут установлены адаптогенные свойства препарата. Во всяком случае, результаты этого опыта позволяют с определенной долей достоверности объяснить ту разницу гастропротективной активности сбора Я3, которая была установлена на моделях острых повреждений желудка по Shay et al. и Заводской (нейродистрофических язвах), с одной стороны, и язвой по Okabe, с другой. Поскольку на всех моделях использован один препарат сравнения - витамин U, для которого, по данным литературы, не установлены выраженные нейро- и психотропные свойства, то сравнение с его эффектами можно использовать в качестве критерия для сопоставления результатов, полученных для сбора Я3 па разных моделях язвы желудка. Исходя из этого, мы склонны считать, что менее выраженный при моделировании острых язв желудка гастропротективный эффект сбора Яз может объясняться наличием у него некоторого психостимулирующего эффекта. Тот факт, что гастропротективный эффект все-таки проявился, несколько не укладывается в рамки традиционных представлений о фармакотерапии нейрогенных язв желудка. Вероятно, в механизмах гастропротекции немаловажное значение имеет местный метаболический эффект препаратов и оптимизирование гомеостаза на уровне целостного организма, чем, в частности, можно объяснить антиульцерогенное действие адаптогенов.
Активность амилазы и концентрацию креатинина в сыворотке крови определяли на 14-е и 28-е сутки течения язвы желудка по Okabe. Более ранние сроки не рассматривали, поскольку нельзя было исключить влияние ближайших послеоперационных осложнений на поджелудочную железу и почки. Препараты - кверцетин (50 мг/кг) и сбор Я3 (300 мг/кг) - вводили 14 дней от начала эксперимента.
На 14-е сутки активность амилазы сыворотки крови для контрольной группы была меньше уровня интактных животных на 51,8% (Р<0,001), напротив, уровень креатииина возрос на 119,1% (P<0,001), параллельно этому в 4,4 раза (Р<0,001) увеличился амилазо-креатининовый индекс. Следует отметить, что рост амилазо-креатининового индекса - показателя, характеризующего степень выраженности деструктивных процессов в поджелудочной железе, и креатинина, свидетельствующего о падении фильтрационной функции почек, положительно коррелирует с нарастанием уровня МДА в этих органах, а вот снижение активности амилазы в сыворотке крови находится в противофазе с содержанием МДА в поджелудочной железе. В целом полученные данные свидетельствуют о немаловажном значении процессов ПОЛ в повреждении клеточно-тканевых структур поджелудочной железы и почек, что ведет к депрессии их функциональной активности.
Использование сбора Я3 вносит значительные коррективы в показатели: активность амилазы сыворотки крови животных опытной группы превышает контрольные показатели на 54,6% (Р<0,001), но остается на 25,4% (Р<0,005) ниже уровня интактных животных, а амилазокреатинновый индекс составляет 34,1% (Р<0,005) от уровня контрольной группы и лишь на 22,6% превышает соответствующий показатель интактной группы. Весьма выраженное действие препарат оказал на уровень креатинина сыворотки крови: он был не только достоверно ниже значения контрольного показателя на 60,2% (Р<0,005), но даже несколько ниже уровня интактных животных. Сопоставляя полученные данные с результатами определений содержания МДА в поджелудочной железе и почках на данный срок исследования, можно отметить следующее. Содержание МДА в поджелудочной железе отрицательно коррелирует с функциональной активностью органа по сравнению с интактными: на 34,2% прирост МДА и на 25,4% падение активности амилазы в сыворотке крови; прирост МДА в почках не сказался на уровне креатинина в сыворотке крови. Совсем незначительным было и нарастание уровня амилазо-креатининового индекса. По-видимому, этот показатель не во всех случаях может адекватно отражать масштабы и глубину деструктивных процессов в поджелудочной железе. Чувствительность его может быть в существенной степени снижена при значительных колебаниях функции почек в ту или иную сторону: при резком угнетении клубочковой фильтрации, например, будет снижаться уровень амилазы в моче (значение которой при расчетах амилазо-креатининового индекса:
выносится в числитель), что, естественно, ведет к снижению конечного результата. При этом, как правило, повышается уровень концентрации креатинина в крови, что может скорректировать конечный результат в сторону верификации. Тем не менее значительная зависимость величины конечного результата (амилазо-креатининового индекса) от ряда вариабельных параметров ставит его, на наш взгляд, в разряд не вполне совершенных. Более надежно использовать в диагностике панкреатитов (особенно реактивных) констилляцию из двух параметров - активности амилазы сыворотки крови и уровня перекисей липидов в ней. Для увеличения диагностической значимости предпочтительнее включить сюда же определение амилазы мочи. Что касается значительного снижения (в сравнении и с контрольной, и интактной группами) уровня креатинина в крови на фоне достаточно высоких показателей МДА в почках, то для объяснения этого факта можно привлечь несколько кажущихся нам вероятными предположений.
1. Под действием препарата мобилизуются метаболические резервы поврежденной почки, что позволяет ей эффективно справляться с детоксирующей функцией (например, диуретический эффект).
2. Активирование викарной детоксирующей функции других органов, например, желудка, кишечника, печени, и элиминации креатинина через них.
3. Присоединение механизма "разведения" - сохранение нормального объема циркулирующей крови, низкого гематокрита.
4. Оптимизация энергетического обмена организма с низким процентом превращения креатина в креатинин.
5. Уменьшение белкового катаболизма.
6. Насыщение организма эссенциальными биологически активными веществами, например витаминами Е и С (в значительном количестве имеющихся в составе препарата), при дефиците которых наблюдается креатинемия.
В группе препарата сравнения кверцетина средний показатель активности амилазы был па 58,6% выше уровня контроля (Р<0,005) и на 23,5% меньше показателя интактных животных. Креатинин напротив, был ниже уровня контроля - па 26,2% (Р<0,05), но это значительно превышает показатель группы Я3, чем и объясняется более высокое (на 85,4% больше показателя группы Я3) значение амилазо-креатининового индекса. Эта разница между группами кверцетина и Я3 не принципиальна для различий с группой контроля, так как разница между ними была ощутимой и составляла 48,9% (Р<0,005).
На 28-е сутки эксперимента в группе контроля уровень креатинииа снизился по сравнению с уровнем 14-х суток на 47,6%, но тем не менее еще превышал уровень интактных животных на 14,9% (Р<0,05), что вполне согласуется с данными по определению содержания МДА в почках на этот срок. Интересно отметить, что по отношению к интактной группе относительная величина МДА в органе была выше, чем относительный уровень креатинина в крови. Почти так же - на 48,0% (Р<0,01) - снизился уровень амилазо-креатининового индекса, по был еще достоверно (на 86,9%, Р<0,01) выше уровня интактных животных. Напомним, что уровень МДА в поджелудочной железе контрольной группы был на 65,8% (Р<0,01) выше такового у интактных животных. Так что колебания этих показателей носят содружественный характер. А вот функциональные возможности железы продолжают угнетаться: уровень амилазы сыворотки крови снижается и составляет от уровня интактных 41,6% (Р<0,001) (табл. 48), т.е., несмотря на снижение активности острого воспалительного процесса в поджелудочной железе, ее экзокринная функция затухает. Из этого можно заключить, что секреторный эпителий органа, возможно, пережил необратимые изменения и процесс в целом перешел на другую стадию патологии - стадию хронического дегенеративно-воспалительного течения. В этой связи небезынтересным будет привести визуальное (макроскопическое) морфологическое наблюдение о перерождении органа и замещении его разросшейся жировой тканью. Кроме того, па поздних сроках эксперимента бывает довольно трудно набрать 500 мг ткани, поджелудочной железы для приготовления гомогената, идущего на ТБК-тест (тест на определение МДА). Из литературы известно, что интенсификация процессов ПОЛ активирует патологический липогенез [Меерсон, 1984].
При экспериментальной фармакотерапии сбором Я3 все исследуемые показатели претерпевают положительную динамику. Так, активность амилазы возрастает по сравнению с предыдущим сроком лишь на 6,5%, тем но менее это позитивный сдвиг, поскольку, во-первых, разница с контрольным показателем еще больше увеличилась и составила 31,1% (Р<0,001) и, во-вторых, потому, что этот сдвиг произошел на фоне практически не изменившегося уровня МДА в органе. Содержание креатинииа составило 50,0% от уровня контроля (Р<0,05), а амилазо-креатининовый индекс еще меньше - 42,6% (Р<0,005).
В группе кверцетина в отношении креатинина сыворотки крови и амилазо-креатининового индекса отмечались качественно те же, но количественно менее выраженные, чем в группе Я3, сдвиги. Их значения были меньше соответствующих контрольных показателей на 16,7 (Р<0,05) и 10,7% (Р<0,05). А вот в отношении амилазы сыворотки эта тенденция не была выдержана - уровень ее снизился по сравнению с предыдущим сроком на 34,5%, хотя достоверно превышал соответствующий показатель в контроле - на 10,4% (Р = 0,05), т. е. снижение активности процессов ПОЛ в поджелудочной железе в данном случае не означало сохранение ее функций.
Таким образом, развитие язвы желудка сопровождается активизацией процессов ПОЛ как в локусе непосредственного повреждения - язве желудка, так и в другие органах системы пищеварения, максимально повреждаемых в момент разгара патологического процесса, что свидетельствует об участии липопероксидации в патогенезе местных и экстрагастральных механизмов повреждении и поддержания течения язвенной болезни. Эти выводы подтверждаются данными литературы, свидетельствующими, с одной стороны, о серьезном повреждении органов как системы пищеварения [Дрозд, 1972; Пругло, Чернин, 1978; Пругло, 1979; Попов, 1982; и др.], так и других систем организма, в том числе и выполняющих интегративно-регуляторную функцию - ЦНС и органов эндокринного каскада [Аничков, Заводская, 1965; Мосин, 1981; Крышень, Ткач, 1982; Комаров и др., 1984; и др.].
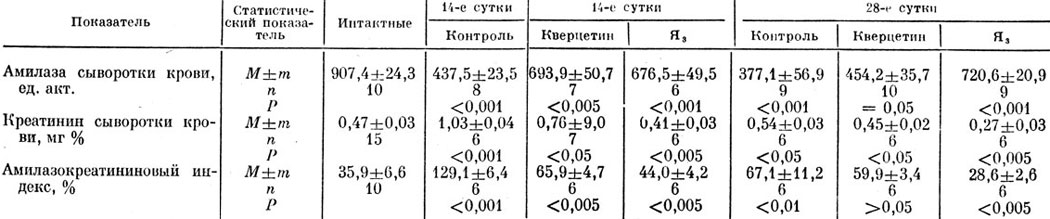
Таблица 48. Показатели функционального состояния поджелудочной железы и почек при экспериментальной фармакотерапии язвы желудка по Okabe квернетином и сбором Я3
Состояние органов системы пищеварения имеет большое значение для прогноза язвенной болезни. В настоящее время накоплен огромный фактический материал, свидетельствующий о серьезных нарушениях в структуре и функции пищеварительного тракта, даже в случае так называемой "неосложненной" язвы желудка. Патогенез подобных нарушений во многом остается неясным. В эксперименте показано, что в развитии экстрагастральных синдромов при язвенной болезни принимают участие процессы ПОЛ, к активизации которых могут приводить следующие причины: стресс, ирритация в сегментарных отделах вегетативной нервной системы, нейрогормональные и гуморальные сдвиги, нарушения регионарной гемодинамики с развитием гипоксии, ДВС-синдром, перераспределение нутриентов и в том числе антиоксидантов между органами и др.
Создается впечатление, что активация ПОЛ оказывает большее повреждающее действие на "местный" обмен веществ. Это ведет к развитию собственно желудочных дисфункций, лежащих в основе дебюта, хронизации и рецидивирования язвенной болезни.
Изучению ПОЛ посвящено огромное количество экспериментальных и теоретических работ [Владимиров, Арчаков, 1972; Владимиров и др., 1975; Бурлакова и др., 1975; Прайор, 1979; Меерсон, 1984 и др.] При обсуждении полученных результатов мы остановимся лишь на некоторых патогенетических аспектах неконтролируемого ПОЛ на уровне молекулярной, клеточной и тканевой организации.
Активация процессов ПОЛ приводит к избыточной наработке перекисных радикалов, повреждающих: нуклеиновые кислоты и системы, ответственные за их синтез и репарацию [Збарский, 1982; Меерсон, 1984]; мембраносвязанные ферменты, ответственные за обеспечение энергетического и пластического обмена; каналообразующие белки, обеспечивающие компартмептализацию, селективную проницаемость цитомембран, что, в частности, приводит к утечке в цитозоль, межклеточные пространства кислых гидролаз; электрическому пробою биомембран; инактивации мембраносвязанных рецепторов и т. д. Аквивация ПОЛ имеет значение в ингибировании синтеза простагландинов [Меерсон, 1981], компонентов циклазной системы [Бурлакова и др., 1975], выполняющих цитопротективную функцию в желудке [Кожемякин и др., 1979]. В работах последних лет показана роль продуктов ПОЛ в процессах тромбообразования [Кубатиев, Андреев, 1981], повреждении сосудистой стенки [Мищенко, 1981], патогенетически связанных с формированием гемодинамических нарушений вплоть до ДВС-синдрома [Хапкин, Федотовских, 1985]. Нарушениям микроциркуляции, изменениям местного гемостатического потенциала придается принципиальное значение в ульцерогенезе [Дорофеев и др., 1979] и генезе желудочных кровотечений [Юмашкина, 1976; Поташов и др., 1985]. Повреждение контактных межклеточных взаимодействий [Чуич, 1975; Косько, 1981; Меликянц, 1982] может приводить к увеличению ОДН+ и усиленной эксфолиации клеток из эпителиального пласта. Немаловажное значение имеет повреждающее действие продуктов ПОЛ на сократительные актомиозиновые комплексы [Каган и др., 1977], вызывает паралич митокинетического аппарата и появление характерных для язвенной болезни патологических митозов [Общая патология человека, 1982], увеличение сосудистой проницаемости, атонию и дилятацию желудка. Нельзя оставить в стороне и такой важный аспект в действии перекисей, как влияние на элементы нервной ткани [Прилипко и др., 1982], что, несомненно, сказывается на функции желудочного и кишечного пейсмекеров и в конечном итоге ведет желудочно-кишечный тракт к дисмоторике, характерной для клиники язвенной болезни желудка и луковицы 12-перстной кишки. Наконец, важнейший, на наш взгляд, аспект: язвенная болезнь относится к предраковым состояниям и в этой связи следует считать принципиальным моментом участие свободиорадикального ПОЛ биомембран в процессах канцерогенеза [Збарский, 1982].
Поэтому особую актуальность приобретает факт усиления липопероксидации на модели хронической язвы желудка как общем метаболическом звене процессов ульцерации и малигнизации.
Кратко резюмируя результаты данной серии экспериментов, можно заключить что природный антиоксидант кверцетин в целом оказал положительное влияние на функциональные показатели поджелудочной железы и почек, что является фармакологическим доказательством участия процессов ПОЛ в формировании патогенеза синдромов отраженной патологии при модельной язвенной болезни желудка. Лекарственный растительный сбор Я8 по этим параметрам оказал более выраженное действие.
Для уточнения вопроса о возможном антигистаминовом эффекте исследуемых препаратов проведена серия экспериментов на белых беспородных крысах с использованием методики "меченых" сосудов [Горизонтова и др., 1975]. Результаты экспериментов по количественному распределению сосудов в группы с различной степенью проницаемости для частичек туши после нагрузки гистамином представлены в табл. 49. Гистамин гидрохлорид (0,25 мл 0,1%-ного раствора на 100 г массы виутрибрюшиННО, однократно) инъецировали через 2 ч после введения испытуемых фармакологических агентов. Сразу после инъецирования гистамина внутривенно вводили очищенную тушь (0,2 мл на 100 г массы) и через 30 мин внутрибрюшинно впрыскивали раствор Карнуа (15 мл на 100 г массы). Сосуды подсчитывали до 100 в каждом опыте при одновременной фоторегистрации препаратов брыжейки.
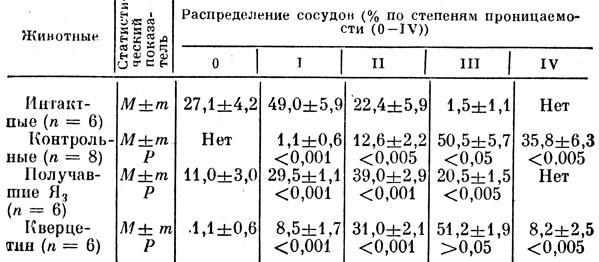
Таблица 49. Влияние кверцетина и сбора Я3 на состояние сосудистой проницаемости для частичек коллоидной туши при нагрузке экзогенным гистамином
Как видно из представленных данных (табл. 49), у интактных животных основной баланс сосудов относится к нулевой и III степеням проницаемости и только у двух животных из шести выявлены сосуды с III степенью проницаемости. То есть при нормальном, физиологическом состоянии организма "сосудистая формула" сдвинута влево. Типичный вид сосудов брыжейки интактной группы крыс представлен на рис. 14.
При введении гистамина картина выглядит совершенно иным образом - формула распределения сосудов по степеням проницаемости резко сдвигается вправо: ни у одного из восьми животных не выявлено сосудов с нулевой степенью проницаемости, сосуды с 1-й степенью проницаемости обнаружены лишь у трех из восьми крыс и их среднее количество составило 1,1% (в интактной группе 49,0%), достоверно отличалось и количество сосудов с III степенью проницаемости - 50,5% против 1,5% в интактной группе. Если в группе интактных животных сосуды с IV степенью не выявлялись ни в одном случае, то в группе контрольных животных они были обнаружены у всех восьми животных и процентное отношение по группе составило 35,8% .
В группе животных, получавших кверцетин, распределение сосудов но степеням проницаемости существенно отличалось от того, что мы наблюдали в контрольной группе. Так, хотя и в небольшом проценте случаев (1,1) отмечена нулевая степень проницаемости у трех животных, в 8,5% (Р<0,001) зафиксированы сосуды I степени проницаемости, причем у всех шести животных; также достоверно больше (Р<0,005) было сосудов со II степенью проницаемости, а вот сосудов с III степенью проницаемости было приблизительно столько же, сколько в группе контроля; сосуды с IV степенью, хоть и были отмечены у всех шести животных, тем не менее их было достоверно (Р<0,005) меньше, чем в контроле.
В еще большей степени отличие от контрольной группы было выражено для группы крыс, получавших Я3. Нулевая степень проницаемости сосудов была отмечена у всех шести животных в группе, и их относительное количество среди общей суммы сосудов было в 10 раз больше, чем то, которое определялось в группе кверцетина. Сосудов с I степенью проницаемости насчитывалось 29,5% (в сравнении с контролем Р<0,001), что в 3,5 раза больше, чем в группе кверцетина. Наибольшее удельное количество сосудов падало на группу со II степенью проницаемости - 39,0% от общей суммы сосудов. Эта величина в 3,1 раза (Р<0,001) превышала соответствующее значение для контрольной группы и в 1,3 раза была больше соответствующего показателя группы кверцетина. Сосудов III степени было в 2,5 раза меньше, чем в группе контроля (Р<0,005), и приблизительно такая же разница была между группой Яз и группой кверцетина. Если по предыдущим группам сосудов разница между данной опытной и контрольной, а также II опытной группахми (группой кверцетина) носила количественный характер, то для группы сосудов с IV степенью проницаемости эта разница была уже качественно отличной: сосудов с IV степенью проницаемости не обнаружено ни в одном из шести препаратов брыжейки крыс.
Сейчас трудно сказать, на какое из звеньев антигистаминной защиты направлено действие исследуемых препа ратов. Принципиальным является тот факт, что в настоящее время решающее значение в механизме противоязвенного действия антигистаминных препаратов - как H2-блокаторов, так и H1-блокаторов, придают не антисекреторному, а именно ангиопротекторному их эффекту. Интересным представляется факт более выраженного антигистаминного действия растительного сбора Я3 в сравнении с флавоноидом кверцетином, который зарекомендовал себя как эффективное сосудоукрепляющее средство.
Таким образом, проведенные эксперименты свидетельствуют, что исследуемые тибетские лекарственные смеси Я1 и Я3 оказали выраженный превентивный антиульцерогенный и язвозаживляющий эффекты на моделях острых и хронической язвы желудка. Углубленное фармакологическое изучение сбора Я3 дает основание сделать вывод о том, что его противоязвенное действие связано с антиоксидантным и антигйстаминным эффектами. Кроме того, было показано, что препарат эффективно корригирует синдромы отраженной патологии, формирующиеся как элемент патогенеза язвенной болезни желудка. По всем исследуемым в данном эксперименте параметрам растительные сборы превосходили по фармакологической эффективности препараты сравнения.
Антиульцерогенное действие лекарственной смеси Я1 обусловлено, по-видимому, присутствием в плодах миробалана хебула большого количества дубильных веществ (до 30%), обеспечивающих местное противовоспалительное действие. Бактерицидная активность и изменение рН-среды вызываются, очевидно, веществами антрахиновой природы, которые содержатся в марене сердцелистной [Гаммерман и др., 1970]. Для корней софоры желтоватой характерна противовоспалительная активность [Абдель-баки Афаф Мохамед, 1980]. Известно, что вещества, тормозящие двигательную функцию желудка, способствуют заживлению язвы [Хаджай и др., 1962], поэтому наличие у всех трех растений, входящих в состав лекарственной смеси Я1, спазмолитической активности должно оказать благотворное действие на процессы эпителизации язвенной поверхности.
Антиульцерогенное действие лекарственной смеси Я, обеспечивается, вероятно, за счет действующих веществ сесквитерпеновой природы из корней и корневищ девясила высокого, служащих исходным сырьем для антиязвенного препарата алантона [Зинченко и др., 1981; Машковский, 1986]. Препараты из корней девясила высокого снижают тонус гладкой мускулатуры кишечника и желчевыводящих путей [Оболенская и др., 1973]. Известно и противоязвенное действие масла из плодов облепихи круши-повой. В масле и соке ее плодов обнаружено 77% жирных кислот, в том числе: 0,3% миристиновой, 26,2% пальмитиновой, 3,2% стеариновой, 45,6% пальмитинолеиновой, 9,4% олеиновой, 10,8% линолевой, 4,5% линоленовой, 2,4-2,6% стеринов, в том числе 62,3% - ситостеринов; каротиноиды [Атлас ареалов..., 1976]. Плоды облепихи - ценное поливитаминное сырье. Масло плодов используют как эпителизирующее, гранулирующее и болеутоляющее средство в гинекологической практике, при лечении ожогов, обмораживающей экземе, язвенной болезни желудка и 12-перстной кишки, как профилактическое средство при лучевой терапии рака [Атлас ареалов..., 1976]. Плоды облепихи крушиновой содержат витамины: С. В, Р, К, фолиевую кислоту, жирное масло 8,6 - 272,6 мг%. В масле и соке облепихи сорта "Катунская" содержится 50 мг% аскорбиновой кислоты; 20 - токоферолов; 0,085 - витамина В1; 0,035 - рибофлавина и 27,9 мг% каротиноидов.
Третий компонент этой смеси - плоды кориандра посевного - содержит эфирные масла - 1,21%, в составе которых линалоол - 67,2%; α-пинен - 2,4; β-пинен; α- и β-терпинены, ацетат 3,1; гераниол - 1,9. Кроме эфирного плоды содержат 10-20% жирного масла, состоящего из глицеридов, олеиновой - 85,1%; линолевой - 10,2%; линоленовой, пальмитиновой кислоты - 6,5%, а также белковые вещества - 10-17%, стероидные соединения, стерины, витамин С, органические кислоты, сахара, кумарины, умбеллиферон, скополетин [Танасиенко, 1985].
Таким образом, лекарственные композиции, входящие в состав более сложных смесей, применяемых для терапии состояний, близких по описанию к таким современным нозоформам, как гастриты (с повышенной и пониженной секреторной активностью), язвенная болезнь, канцер различных отделов желудка, при первичной экспериментальной проверке на различных моделях язвы желудка, показали высокую антиульцерогенную активность.
Углубленное экспериментальное исследование сбора Я3, как более перспективного в фармацевтическом аспекте препарата, показало, что механизм его антиульцерогенного действия связан с антиоксидантной, мембраностабилизирующей и антигистаминной активностью. Растительный сбор Я3 оказал более выраженный, чем витамин U, язвозаживляющий, ранозаживляющий, спаечнолитический и мембраностабилизирующий эффект. Курсовое применение сбора Я3 ведет к более эффективной, нежели у препаратов сравнения - витамина U и кверцетина - коррекции синдромов отраженной патологии. Вероятно, в основе этой коррекции, кроме антиоксидантного эффекта, лежит способность оказывать непосредственное влияние па ход метаболических процессов внутренних органов.
Исследуемый в эксперименте растительный сбор Я3, благодаря широкому набору положительных фармакологических характеристик, может, вероятно, использоваться в системе комплексной терапии заболеваний органов пищеварения с целью оптимизации состояния больных и, возможно, снижения полипрагмазии.
Фармакологическая эффективность исследуемых тибетских лекарственных сборов обеспечивается широким набором биологически активных веществ, представленных в растительном сырье препаратов: эссенциальных соединений (витаминов, микроэлементов и др.), кумаринов, стероидных соединений, стеринов, органических кислот, Сахаров, жирных масел и др., среди которых особое значение мы придаем флавоноидам.
Фармакологическая эффективность препарата с необычной для современной медицины лекарственной формой в виде порошка из суммы нативных растительных компонентов - но существу пищевой добавки, должна привлечь внимание исследователей-фармакологов к подобному разряду препаратов. Вероятно, совсем не случайно восточные медицинские системы на протяжении тысячелетий пользовались такой лекарственной формой.
Результаты экспериментальных исследований позволяют предполагать, что успешная фармакотерапия нозологических форм с многокаскадным и разветвленным патогенезом вряд ли может быть достигнута при использовании чистых в химическом отношении препаратов, так называемых фармакологических "пуль" по Эрлиху [Уголев, 1986]. Скорее, этот результат может быть получен при использовании препаратов, в которых представлен широкий набор биологически активных веществ, в том числе и фитопрепаратов [Соколов, 1985].
|
ПОИСК:
|
© PHARMACOLOGYLIB.RU, 2010-2022
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://pharmacologylib.ru/ 'Библиотека по фармакологии'